Medicinsk expert av artikeln
Nya publikationer
för tidig graviditet
Senast recenserade: 04.07.2025

Allt iLive-innehåll är mediekontrollerat eller faktiskt kontrollerat för att säkerställa så mycket faktuell noggrannhet som möjligt.
Vi har strikta sourcing riktlinjer och endast länk till välrenommerade media webbplatser, akademiska forskningsinstitut och, när det är möjligt, medicinsk peer granskad studier. Observera att siffrorna inom parentes ([1], [2] etc.) är klickbara länkar till dessa studier.
Om du anser att något av vårt innehåll är felaktigt, omodernt eller på annat sätt tveksamt, välj det och tryck på Ctrl + Enter.
Postmatur graviditet är ett av de problem som traditionellt avgör stort vetenskapligt och praktiskt intresse, orsakat först och främst av ogynnsamma perinatala resultat i denna patologi.
Inom den inhemska obstetriken tror man att en graviditet efter amning, som varar i mer än 287–290 dagar, åtföljs av intrauterint lidande hos fostret och slutar med födseln av ett barn med tecken på biologisk övermognad, vilket avgör den höga risken för att utveckla ante/intranatalt distresssyndrom och svår neonatal anpassning.
Epidemiologi
Incidensen av graviditeter efter fullgången tid är cirka 7 % av alla graviditeter (Martin et al., 2007).
American College of Obstetricians and Gynecologists definierar postmatur graviditet som en graviditet som varar i mer än 42 veckor (294 dagar). Incidensen är i genomsnitt cirka 10 %. I de flesta europeiska länder definieras postmatur graviditet som en graviditet som varar 294 dagar eller mer, med undantag för Portugal (287 dagar eller mer) och Irland (292 dagar eller mer). Incidensen av postmatur graviditet i Europa är cirka 3,5–5,92 %.
Samtidigt föds ett barn med tecken på postmognad inte alltid med postmognad, och tvärtom kan tecken på postmognad observeras hos ett foster som föds före utgången av 290 dagars graviditet, vilket sannolikt beror på individuell tidpunkt och egenskaper hos graviditetsutvecklingen. Det postmogna fostrets funktionella tillstånd förtjänar dock mer uppmärksamhet, med tanke på den höga frekvensen av allvarliga komplikationer som mekoniumaspirationssyndrom, hypoxisk-ischemisk skada på centrala nervsystemet, hjärtmuskeln, njurarna, tarmarna, vilket leder till fostrets ante- och intranatala död.
Postnatal graviditet anses vara en faktor som ökar frekvensen av komplikationer under förlossningen och leder till en ökning av perinatal sjuklighet och dödlighet. De vanligaste perinatala komplikationerna vid postnatal graviditet är dödfödsel, kvävning och förlossningstrauma. E. Ya. Karaganova, IA Oreshkova (2003), efter att ha genomfört en grundlig analys av perinatala utfall hos 499 patienter med postnatal graviditet beroende på graviditetsålder, fann att när graviditetsåldern ökar från 41 till 43 veckor ökar andelen perinatal sjuklighet. Vid 43 veckors graviditet ökar således frekvensen av hypoxisk-ischemisk CNS-skada med 2,9 gånger, kvävning - med 1,5 gånger och aspirationssyndrom - med 2,3 gånger jämfört med fullgångna nyfödda med en graviditetsålder på högst 41 veckor. Vid en graviditetstid på mer än 41 veckor upptäcktes tecken på fosteransträngning före förlossningens början hos 67,1% av fostren (hos hälften av dem vid en graviditetstid på 42–43 veckor), blandning av mekonium i fostervattnet - hos 31,6%, oligohydramnios - hos 50,9% av patienterna.
Orsaker för tidig graviditet
Den vanligaste orsaken till graviditeter efter fullgången tid är felaktig datering (Neilson, 2000; Crowley, 2004). Användningen av kliniska standardkriterier för att bestämma beräknat förlossningsdatum tenderar att överskatta graviditetsåldern och ökar därför incidensen av graviditeter efter fullgången tid (Gardosi et al., 1997; Taipale och Hiilermaa, 2001). Kliniska kriterier som vanligtvis används för att bekräfta graviditetsålder inkluderar sista menstruationen, livmoderstorlek bedömd genom bimanuell undersökning under första trimestern, uppfattning av fosterrörelser, auskultation av fostrets hjärtljud och ögonbottenhöjd. Engångsgraviditet.
När en graviditet inträffar efter fullgången tid är orsaken vanligtvis okänd.
Riskfaktorer
Vid analys av den somatiska, obstetriska och gynekologiska anamnesen, samt egenskaperna hos den aktuella graviditeten, noteras riskfaktorer som indikerar möjligheten att utveckla en posttermin och förlängd graviditet.
Riskfaktorer för graviditet efter fullgången tid:
- den gravida kvinnan är över 30 år gammal;
- historia av sexuellt överförbara infektioner (STI) och kroniska inflammatoriska sjukdomar i livmoderhinnorna;
- indikation på en historia av försenad leverans;
- "omogen" eller "otillräckligt mogen" livmoderhals vid 40 veckor eller mer av graviditeten.
Riskfaktorer för förlängd graviditet:
- den gravida kvinnans ålder är från 20 till 30 år;
- äggstocksdysfunktion med oregelbunden eller förlängd (≥ 35 dagar) menstruationscykel;
- skillnad mellan graviditetsåldern bestämd utifrån den första dagen av den sista menstruationen och ultraljudsundersökningen.
Allmänna riskfaktorer inkluderar förstföderskap, tidigare graviditeter efter fullgången tid (Alfirevic och Walkinshaw, 1994; Mogren et al., 1999; Olesen et al., 1999), manligt foster (Divon et al., 2002), fetma (Usha Kiran et al., 2005; Stotland et al., 2007), hormonella faktorer och genetisk predisposition (Laursen et al., 2004).
Det är inte känt hur kroppsmasseindex (BMI) påverkar graviditetens längd och förlossningstidpunkt, men intressant nog är överviktiga kvinnor mer benägna att uppleva graviditeter efter förlossningen (Usha Kiran et al., 2005), medan kvinnor med lågt BMI har en högre risk för graviditeter efter förlossningen och för tidig födsel (förlossning före 37 veckors graviditet) (Hickey et al., 1997). Eftersom fettvävnad är hormonellt aktiv (Baranova et al., 2006) och överviktiga kvinnor kan ha förändrad metabolisk status, är det möjligt att endokrina faktorer som är involverade i förlossningens början är förändrade hos överviktiga kvinnor.
Genetiska faktorer kan vara associerade med förlängd graviditet. Kvinnor som själva har haft en graviditet efter fullgången tid har en högre risk att få en graviditet efter fullgången tid (relativ risk på 1,3) (Mogren et al., 1999). Kvinnor som har haft en tidigare graviditet efter fullgången tid har en ökad risk att få en efterföljande graviditet efter fullgången tid (27 % med en tidigare graviditet efter fullgången tid och 39 % med två tidigare förlängda graviditeter) (Kistka et al., 2007).
Patogenes
Patogenesen för postmatur graviditet är inte helt klarlagd. Som visas ovan har vissa riskfaktorer som är förknippade med postmatur graviditet identifierats med några möjliga förklaringar, men patogenesen för detta tillstånd är ännu inte klarlagd. Trots den förbättrade förståelsen av förlossning de senaste åren saknar vi fortfarande klarhet kring de exakta mekanismer som initierar förlossningen och främjar dess utveckling. För att bättre förstå patogenesen för postmatur graviditet är det viktigt att belysa patofysiologin för förlossningen och försöka förstå varför dessa mekanismer inte utlöses vid postmatur graviditet eller, omvänt, utlöses tidigare vid förtidsförlossning. Det verkar logiskt att det faktiskt finns en gemensam grund eller ett gemensamt samband mellan dessa tre tillstånd. Mekanismerna för förlossningen involverar interaktionen mellan hormonella, mekaniska och inflammatoriska processer där moderkakan, modern och fostret spelar en viktig roll.
Placentaproduktion av kortikotropinfrisättande peptid (CRH) är associerad med graviditetens längd (McLean et al., 1995). Placenta CRH-syntes ökar exponentiellt allt eftersom graviditeten fortskrider och når sin topp vid tidpunkten för förlossningen. Kvinnor som föder för tidigt har en snabbare exponentiell tillväxttakt än kvinnor som föder vid fullgången tid, medan kvinnor som föder senare har en långsammare tillväxttakt (Ellis et al., 2002; Torricelli et al., 2006). Dessa data tyder på att postmatur förlossning beror på förändrade biologiska mekanismer som reglerar graviditetens längd. Detta kan bero på en ärftlig predisposition till följd av polymorfismer i gener i den fysiologiska vägen som kopplar CRH till förlossningen. Det är också möjligt att moderns fenotyp kan förändra moderns vävnaders reaktion på normala hormonella signaler vid förlossningen, vilket kan förekomma hos överviktiga kvinnor.
CRH kan direkt stimulera fostrets binjure att producera DHEA, en föregångare till placentas östriolsyntes (Smith et al., 1998). Moderns plasmakoncentrationer av CRH korrelerar med östriolkoncentrationer (Smith et al., 2009). Den CRH-inducerade ökningen av östriol ökar snabbare än östradiolnivåerna i sen graviditet, vilket resulterar i ett ökat förhållande mellan östriol och östradiol som tros skapa en östrogen miljö under de sista veckorna av graviditeten. Samtidigt saktar ökningen av moderns plasmaprogesteron som sker under graviditeten ner eller minskar till och med i sen graviditet. Detta kan bero på CRH-hämning av placentas progesteronsyntes (Yang et al., 2006). Således minskar den graviditetsfrämjande (avslappningsfrämjande) effekten av progesteron i takt med att den förlossningsfrämjande (livmoderkontraktionsfrämjande) effekten av östriol ökar. Dessa förändringar i förhållanden har observerats vid för tidigt födda graviditeter, singelgraviditeter och tvillinggraviditeter (Smith et al., 2009). Situationen vid graviditeter efter amning är okänd.
Symtom för tidig graviditet
Symtomkomplexet hos ett övermogen foster beskrevs först av Ballantyne (1902) och Runge (1948), vilket är anledningen till att det kallas Ballantyne-Runge syndrom, inklusive avsaknad av ostliknande fett, torrhet och maceration av den nyföddas hud ("bad"fötter, handflator), såväl som i ljumsk- och armhålsveck, långa naglar, täta skallben, smala suturer och minskade fontaneller, grönaktig eller gulaktig färgning av huden, fosterhinnorna och navelsträngen. Andra observationer tyder på förlängd graviditet.
En förlängd graviditet, som varar mer än 287 dagar, åtföljs inte av fosterlidande och slutar med födelsen av ett friskt barn utan tecken på övermognad. Därför anses en förlängd graviditet vara ett fysiologiskt tillstånd som syftar till fostrets slutliga mognad.
Komplikationer och konsekvenser
Postmatur graviditet är förknippad med ökad rörlighet och sjuklighet hos foster och nyfödda, såväl som morbiditet hos modern. Dessa risker är större än man ursprungligen trodde. Tidigare underskattades riskerna av två skäl. För det första publicerades tidigare studier av postmatur graviditet innan ultraljud blev en rutinmässig metod för att definiera graviditet. Som ett resultat var många av de graviditeter som inkluderades i studierna faktiskt inte postmatura. Den andra anledningen är relaterad till själva definitionen av dödfödsel. Dödfödslar har traditionellt beräknats med hjälp av graviditeter som förlösts vid en given graviditetsålder, snarare än pågående (ofödda) graviditeter. Detta kommer att minska andelen dödfödslar vid postmatur graviditeter, eftersom fostret, när det väl är förlöst, inte längre riskerar intrauterin fosterdöd (IUFD). Således är den lämpliga nämnaren inte alla födslar vid en given graviditetsålder, utan pågående (ofödda) graviditeter (Rand et al., 2000; Smith, 2001; Caughey et al., 2003).
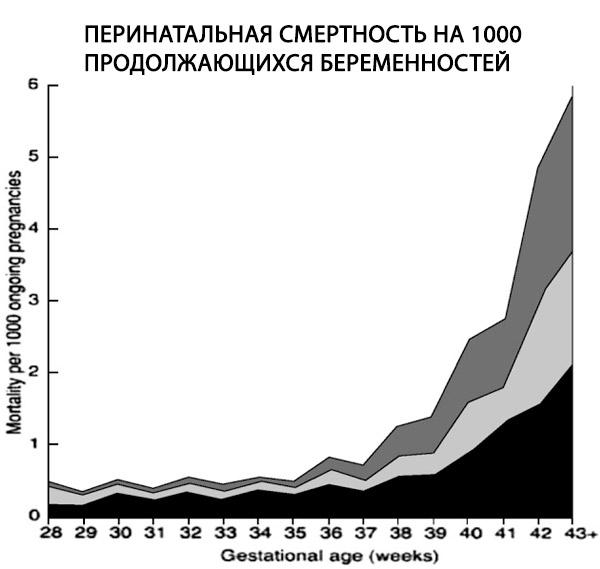
En retrospektiv studie av över 170 000 enlingfödslar med lämplig nämnare visade en sexfaldig ökning av andelen dödfödslar vid graviditeter efter utgången av graviditeten, från 0,35 till 2,12 per 1000 pågående graviditeter (Hilder et al., 1998).
Komplikationer hos fostret och nyfödda
Perinatal dödlighet, definierad som dödfödslar plus tidiga neonatala dödsfall, är dubbelt så hög vid 42 veckors graviditet som vid fullgången tid (4–7 respektive 2–3 per 1 000 födslar). Den ökar fyrfaldigt vid 43 veckor och fem till sjufaldigt vid 44 veckor (Bakketeig och Bergsjo, 1989; Feldman, 1992; Hilder et al., 1998; Cotzias et al., 1999). Dessa data visar också att foster- och neonataldödligheten, beräknad per 1 000 pågående graviditeter, ökar kraftigt efter 40 veckor (Hilder et al., 1998) (Hilder et al., 1998).
Uteroplacental insufficiens, mekoniumaspiration och intrauterin infektion anses vara de främsta orsakerna till den ökade perinatala dödligheten i dessa fall (Hannah, 1993).
Fostermorbiditet är också ökad vid graviditeter efter fullgången tid och graviditeter som fortskrider efter 41 veckor. Detta inkluderar mekoniumpassage, mekoniumaspirationssyndrom, makrosomi och dysmognad. Graviditeter efter fullgången tid är också en oberoende riskfaktor för lågt pH i navelsträngen (neonatal acidemi), låga 5-minuters Apgar-poäng (Kitlinski et al., 2003), neonatal encefalopati (Badawi et al., 1998) och spädbarnsdödlighet under det första levnadsåret (Hilder et al., 1998; Cotzias et al., 1999; Rand et al., 2000). Även om vissa av dessa spädbarnsdödsfall tydligt är ett resultat av perinatala komplikationer såsom mekoniumaspirationssyndrom, har de flesta en okänd orsak.
Omkring 20 % av postmatura foster har dysmaturitetssyndrom, vilket hänvisar till nyfödda med drag som liknar kronisk intrauterin tillväxthämning på grund av uteroplacental insufficiens (Vorherr, 1975; Mannino, 1988). Dessa inkluderar tunn, rynkig, flagnande hud (överdriven fjällning), tunn kropp (undernäring), långt hår och naglar, oligohydramnios och frekvent passage av mekonium. Dessa gravida kvinnor har en ökad risk för navelsträngskompression på grund av oligohydramnios, mekoniumaspiration och kortsiktiga neonatala komplikationer såsom hypoglykemi, kramper och andningssvikt.
Risker för modern
Postmatur graviditet är förknippad med betydande risker för modern. Risken är ökad:
- förlossningsdystoki (9–12 % jämfört med 2–7 % vid fullgången förlossning);
- svåra perineala lacerationer (lacerationer av 3:e och 4:e graden) associerade med makrosomi (3,3 % jämfört med 2,6 % vid fullgången graviditet);
- operativ vaginal förlossning; och
- fördubbling av andelen kejsarsnitt (14 % jämfört med 7 % vid fullgången tid) (Rand et al., 2000; Campbell et al., 1997; Alexander et al., 2000; Treger et al., 2002).
Kejsarsnitt är associerat med en högre incidens av endometrit, blödningar och tromboembolisk sjukdom (Alexander et al., 2001; Eden et al., 1987).
I likhet med neonatala utfall ökar även moderns morbiditet med fullgången graviditet upp till 42 veckors graviditet. Komplikationer som korioamnionit, allvarliga perineala lacerationer, kejsarsnitt, postpartumblödning och endomyometrit ökar efter 39 veckors graviditet (Yoder et al., 2002; Caughey och Bishop, 2006; Heimstad et al., 2006; Caughey et al., 2007; Bruckner et al., 2008;).
Diagnostik för tidig graviditet
Traditionell diagnostik av graviditeter efter amning består av adekvat beräkning av graviditetsåldern. Samtidigt inkluderar de mest exakta metoderna i nuvarande skede beräkningar baserade på den första dagen av den sista menstruationen och ultraljudsdata från 7 till 20 graviditetsveckor. Ett antal författare anser att dessa två metoder är likvärdiga. Vissa forskare föreslår dock att man enbart förlitar sig på ultraljudsbiometridata vid bestämning av graviditetsåldern vid graviditeter efter amning. Bland riskfaktorerna för graviditeter efter amning finns ett antal egenskaper hos den somatiska, obstetriska och gynekologiska anamnesen samt förloppet av den aktuella graviditeten.
Från den somatiska anamnesen framhäver många författare föräldrarnas ålder över 30 år, förekomst av extragenital patologi hos modern. Bland kännetecknen för den obstetriska och gynekologiska anamnesen bör uppmärksamhet ägnas åt menstruationsdysfunktion, förekomst av aborter och spontana missfall, inflammatoriska sjukdomar i livmoderbihangen, en historia av sena födslar och 3 eller fler kommande födslar.
Laboratoriediagnostik av graviditet efter fullgången tid
Allt eftersom graviditetstiden efter fullgången tid ökar sker en progressiv utarmning av kallekrein-kinin-systemet, vilket manifesteras i extremt lågt kininogeninnehåll (0,25–0,2 μg/ml, med N=0,5 μg/ml), låg aktivitet av kallekrein, dess hämmare och spontan esterasaktivitet i blodplasma efter 41 veckors graviditet.
Vid graviditet efter amning observeras en intensifiering av lipidperoxidationsprocesserna både i den gravida kvinnans kropp och i fostrets kropp, vilket bidrar till hämningen av membranbindande enzymer i subcellulära strukturer. Som ett resultat försämras avgiftnings- och energiproduktionsfunktionerna avsevärt och som en konsekvens ackumuleras exogena och endogena toxiska metaboliter, endotoxemi utvecklas, som fortskrider allt eftersom graviditetstiden ökar. Intensiteten av endotoxemi kan bedömas genom erytrocyternas sorptionskapacitet och genom koncentrationen av medelmolekylära proteiner. En ökning av peroxidation och endogen förgiftning korrelerar med svårighetsgraden av fosterhypoxi.
Postmatur graviditet kännetecknas av ett lågt innehåll av prostaglandin F2α, som syntetiseras i decidua och myometrium och är den huvudsakliga modulatorn för utvecklingen av förlossningen.
Vid en graviditetstid på mer än 41 veckor noteras en ökning av plasmaviskositet, urinsyrakoncentration och en minskning av koncentrationen av fibrinogen, antitrombin III och trombocytantal. Koncentrationen av fetalt fibronektin > 5 ng/ml i cervikovaginalt sekret hos kvinnor med en graviditetstid på mer än 41 veckor indikerar en hög biologisk beredskap hos kroppen för förlossning och att den insjuknar spontant inom de närmaste 3 dagarna. Känsligheten och specificiteten för denna metod är 71 respektive 64 %.
Det är oerhört viktigt att studera egenskaperna hos det fetoplacenta komplexets och fostrets funktionella tillstånd under graviditet efter amning (ultraljud, Doppler och kardiotokografiska studier). Under den ekografiska studien utförs fetometri för att bestämma fostrets uppskattade vikt och bedöma dess anatomiska utveckling. I 12,2% av fallen upptäcks IUGR av I-II grader, vilket inte signifikant skiljer sig från frekvensen av detektion av syndromet vid långvarig graviditet. Samtidigt upptäcktes i 80% av fallen en asymmetrisk form av IUGR och i 20% - en symmetrisk form. Graviditet efter amning kännetecknas av detektion av ekografiska tecken på uttalade involutionsdystrofa förändringar (GIII med petrifikationer). Medelvärdet för fostervattenvolymindex i gruppen efter amning var 7,25 ± 1,48, typiskt för graviditet efter amning är detektion av en minskad mängd fostervätska.
Dopplerstudie
Den viktigaste faktorn för att förutsäga perinatala resultat är att fastställa stadierna av fostrets hemodynamiska störningar under graviditeten efter fullgången tid.
- Steg I - störning av intraplacenta och fetoplacenta blodflöde. I detta skede finns inga störningar i arteriell och venös hemodynamik hos foster. En ökning av kärlmotståndet noteras i navelsträngsartären och dess terminala grenar, såväl som i spiralartärerna. Indikatorerna för gaskompositionen och syra-basbalansen i navelsträngsblodet ligger inom normala gränser.
- Steg II - centralisering av fostrets blodcirkulation. Hypoxemi observeras i den nyföddes blod vid födseln. I detta skede skiljer man mellan två på varandra följande steg.
- IIa - initiala tecken på centralisering av fosterarteriell cirkulation med oförändrat venöst och intrakardiellt blodflöde, kännetecknat av:
- en minskning av resistansen i MCA (med högst 50%) eller en ökning av vaskulär resistans i aorta;
- sänkning av CPC (till 0,9);
- en ökning av motståndet i fostrets njurartärer med högst 25% av normen.
- IIb - måttligt uttryckt centralisering av blodcirkulationen med nedsatt blodflöde i venös kanal och ökat blodflöde till aortaklaffen. I detta skede upptäcks följande:
- samtidig ökning av kärlmotståndet i aorta och minskning i den mellersta cerebrala artären;
- minskning av CPC;
- ökning av den genomsnittliga blodflödeshastigheten (Tamx) i venkanalen;
- ökning av den genomsnittliga linjära och volumetriska blodflödeshastigheten vid aortaklaffen.
- IIa - initiala tecken på centralisering av fosterarteriell cirkulation med oförändrat venöst och intrakardiellt blodflöde, kännetecknat av:
- Steg III - uttalad centralisering av fostrets cirkulation med nedsatt venöst utflöde och dekompensation av central och intrakardiell hemodynamik. Hypoxemi i kombination med acidos och hyperkapni noteras i navelsträngsblodet hos den nyfödda vid födseln. Dopplerometriska indikatorer i detta skede kännetecknas av:
- en minskning av vaskulärt motstånd i SMA med mer än 50% av normen, en minskning av CPC under 0,8;
- progressiv ökning av kärlmotståndet i aorta och njurartärerna med mer än 80 %;
- i venkanalen - en ökning av S/A-förhållandet, PIV (mer än 0,78) och en minskning av Tamx;
- i vena cava inferior - en ökning av PIV, IPI och %R (mer än 36,8%);
- i halsvenerna - en ökning av S/A-förhållandet, PIV (över 1,1) och en minskning av Tamx;
- en minskning av den genomsnittliga linjära och volymetriska hastigheten vid aorta- och lungstammens ventiler;
- ökad hjärtfrekvens, minskad slagvolym, vänsterkammars ändsystoliska och änddiastoliska volymer samt hjärtminutvolym.
De identifierade stadierna av fostrets hemodynamiska förändringar återspeglar den konsekventa utvecklingen av dess funktionella tillståndsstörningar under tillstånd med kronisk intrauterin hypoxi under posttermin graviditet. När hypoxemi i kombination med hyperacidemi och hyperkapni detekteras i navelsträngsblodet hos en nyfödd, är frekvensen av negativa perinatala utfall 4,8 gånger högre jämfört med gruppen med isolerad hypoxemi. Följaktligen återspeglar hyperacidemi och hyperkapni uttalade metabola störningar hos fostret och en progressiv försämring av dess tillstånd under tillstånd med kronisk hypoxi under posttermin graviditet.
Kardiotokografi
Vid utförande av denna metod i stadium I upptäcks initiala tecken på kronisk intrauterin hypoxi (20,93%) och måttlig fetal hypoxi (6,97%). I stadium IIa ökade frekvensen av initiala tecken på fetal hypoxi med 2 gånger, vid måttlig hypoxi - med 4,13 gånger. I stadium IIb ökar frekvensen av måttlig och svår fetal hypoxi signifikant. I stadium III upptäcktes endast svår (65,1%) och måttlig (30,2%) fetal hypoxi.
Programmet för screeningundersökning av gravida kvinnor inkluderar:
- identifiering av gravida kvinnor som riskerar att bli gravida efter fullgången tid;
- ultraljudsfetometri med bedömning av tecken på mognad hos det nyfödda barnet;
- bedömning av mängden och kvaliteten på fostervätska;
- bedömning av placentans mognadsgrad;
- kardiotokografi;
- bedömning av fosterhemodynamik (arteria cerebri media, aorta, venös kanal, vena cava inferior);
- bedömning av fostrets biofysiska profil;
- bedömning av livmoderhalsmognad;
- amnioskopi.
Hur man undersöker?
Differentiell diagnos
Under en omfattande undersökning av kvinnor med långvarig graviditet avslöjas följande:
- i 26,5 % av observationerna - grad II, i 51,8 % - grad III placentamognad;
- i 72,3% av observationerna - normal mängd fostervätska;
- i 89,2% av observationerna - normala indikatorer på foster-placenta blodflöde och i 91,6% - normalt cerebroplacenta förhållande;
- i 100% av observationerna - normala indikatorer på fostrets centrala hemodynamik, dess transvalvulära och venösa blodflöde;
- En minskning av CPC med normala indikatorer på fetoplacentalt och fosterblodflöde indikerar förekomsten av avvikelser i fostrets funktionella tillstånd och är karakteristiskt för IUGR, intrauterin infektion och kronisk fosterhypoxi.
Vem ska du kontakta?
Behandling för tidig graviditet
Noggrann graviditetsdatering är avgörande för diagnos och behandling av graviditeter efter fullgången tid (Mandruzzato et al., 2010). Den sista menstruationen har traditionellt använts för att beräkna förväntat förlossningsdatum. Emellertid kan många felaktigheter förekomma på grund av oregelbunden cykel, nyligen använt hormonellt preventivmedel eller blödningar tidigt i graviditeten.
Rutinmässig ultraljudsundersökning för graviditet har visat sig minska andelen falskt positiva diagnoser och därmed den totala andelen graviditeter efter fullgången tid från 10–15 % till cirka 2–5 %, vilket minimerar onödiga ingrepp (Bennett et al., 2004; Caughey et al., 2008a; 2009).
Målen för behandling av graviditet efter fullgången tid är: korrigering av fostrets hemodynamiska störningar, förebyggande av fosterprogression under förlossningen, förberedelse av födelsekanalen för förlossning, igångsättning av förlossning.
Indikationer för sjukhusvistelse
Överskridande av graviditetsåldern på 40 veckor och 3 dagar med ett exakt beräknat födelsedatum, förekomst av riskfaktorer för graviditet efter amning och otillräckligt förberedd födelsekanal.
Läkemedelsbehandling av graviditet efter fullgången tid
För att korrigera fostrets tillstånd under graviditeten efter amning används läkemedlet hesobendin + etamivan + etofillin (instenon) - ett kombinationsläkemedel med en neurobeskyddande effekt baserad på ömsesidig förstärkning av effekterna av dess komponenter.
Indikationer för administrering av läkemedlet hesobendin + etamivan + etofillin:
- nedsatt blodflöde i fostrets navelsträngsartär (SDO > 2,7, IR > 0,65);
- minskning av cerebroplacental koefficient (CPC < 1,10);
- initiala tecken på centralisering av fostrets cirkulation;
- Initiala tecken på fosterhypoxi enligt CTG-data. De listade faktorerna som indikerar initiala tecken på fosternöd kräver inte akut förlossning, men indikerar behovet av att korrigera dess tillstånd genom att öka fostrets hjärnas anpassningsförmåga under förlossningen.
Förberedelser inför förlossning efter graviditet
Mekaniska metoder för cervikal irritation:
- Lösning av fosterblåsans nedre pol. Lösning av fosterblåsans nedre pol kan också leda till ökad syntes av prostaglandiner och "mognad" av livmoderhalsen. Lösning av fosterblåsans nedre pol, utförd dagligen eller 2-3 gånger i veckan, hjälper till att förbereda livmoderhalsen för förlossning och sätta igång förlossningen. Denna metod är mycket effektiv, enkel att utföra, har låg frekvens av biverkningar och är billig. Nackdelarna inkluderar obehag som den gravida kvinnan upplever under undersökningen, sällsynta blödningar och risken för bristning av fosterhinnorna.
- Ballongvidgning av livmoderhalsen. För ballongvidgning av livmoderhalsen används en Foley-ballongkateter. Den förs in och blåses upp i livmoderhalskanalen. Denna metod expanderar mekaniskt livmoderhalskanalen och förbättrar syntesen av prostaglandiner. Genom katetern är det möjligt att föra in en saltlösning i det extra-amniotiska utrymmet, vilket expanderar det nedre livmodersegmentet och även underlättar förlossningens början.
- Mekaniska dilatatorer av naturligt och syntetiskt ursprung. För att förbereda livmoderhalsen för förlossningen används livmoderhalsdilatatorer av naturligt ursprung - laminaria och syntetiska - dilapan, gipan, lamicel, vilka är sonder med en diameter på 2 till 4 mm och en längd på 60-65 mm. Laminaria är tillverkade av naturligt material från algen Laminaria japonicum. Syntetiska dilatatorer tillverkas av kemiskt och biologiskt inerta polymerer med god hygroskopicitet. Sonderna/dilatatorerna förs in i livmoderhalskanalen i önskad mängd. På grund av sin hygroskopicitet absorberar de vätskan i livmoderhalskanalen, expanderar avsevärt och utövar radiellt tryck på livmoderhalskanalen. De öppnar mekaniskt livmoderhalsen och underlättar förlossningens början. Syntetiska dilatatorer av livmoderhalskanalen orsakar inte obehag och tolereras väl av patienter. Den begränsade användningen av syntetiska dilatatorer är förknippad med försiktighet på grund av deras långa vistelse i livmoderhalskanalen, vilket ökar risken för stigande infektion. De beskrivna mekaniska verkningsmetoderna på livmoderhalsen orsakar en reaktion av syntesen av endogena prostaglandiner E2 i livmoderhalsen, vilket bidrar till en minskning av mängden och destabiliseringen av kollagen i dess struktur, vilket har en avslappnande effekt på glatt muskulatur. Dessutom anses prostaglandiner E2 vara dominerande i början av förlossningen.
Mediciner
Preparat av prostaglandin E2-gruppen används. De vanligaste, inom praktisk obstetrik testade, medicinska medlen för att förbereda livmoderhalsen för förlossning och framkalla förlossning inkluderar preparat av prostaglandiner E2. Prostaglandiner E2 finns i olika doseringsformer: i form av geler för intracervikal användning, vaginaltabletter och pessarer. Effektiviteten av prostaglandiner E2 för att mogna livmoderhalsen och initiera förlossning når 80–83 %. Emellertid kan deras användning leda till utveckling av okoordinerad, våldsam förlossning och för tidig lossning av en normalt placerad placenta. Följaktligen bör prostaglandiner E2 endast administreras på förlossningskliniker med obligatorisk kardiotokografisk övervakning av fostrets hjärtaktivitet och livmoderkontraktilitet.
Patientutbildning
Nödvändigtvis:
- att lära kvinnor att föra en menstruationskalender för att säkerställa förmågan att exakt beräkna graviditetsåldern och förfallodagen; att räkna fosterrörelser för att snabbt fastställa risken för fosterhypoxi när dess motoriska aktivitet minskar eller ökar;
- informera patienten om behovet av en grundlig bedömning av fostrets tillstånd vid en graviditetsperiod på mer än 40 veckor och 3 dagar och eventuell sjukhusvistelse i närvaro av ogynnsamma prognostiska faktorer.
Vidare hantering
Standard för undersökning och behandling av kvinnor med en graviditetstid som överstiger 40 veckor:
- Utför differentialdiagnostik av posttermin och förlängd graviditet.
Postmatur graviditet bör övervägas i följande fall: den första förlossningen hos en gravid kvinna över 30 år, en regelbunden menstruationscykel, en historia av sexuellt överförbara infektioner och kroniska inflammatoriska sjukdomar i livmoderbihangen, indikation på sen förlossning, följsamhet till graviditetsåldern beräknad utifrån den första dagen av den senaste menstruationen och ultraljudsdata utförda mellan 7 och 20 graviditetsveckor, vid närvaro av en "omogen" eller "otillräckligt mogen" livmoderhals, detektion av en placenta av stadium GIII-mognad eller oligohydramnios under ultraljud.
Långvarig graviditet indikeras av: den gravida kvinnans ålder från 20 till 30 år; äggstocksdysfunktion med oregelbunden eller förlängd (> 35 dagar) menstruationscykel; skillnad mellan graviditetsåldern bestämd av den första dagen av den sista menstruationen och ultraljudsundersökning; upptäckt av en "mogen" livmoderhals; placenta med mag- och tarmmognad utan petrifikationer och en normal mängd fostervätska under ultraljud.
- För att korrekt bedöma fostrets tillstånd och förhindra negativa perinatala utfall måste alla gravida kvinnor med en graviditetsperiod på mer än 40 veckor genomgå Doppler-ultraljudsundersökning av fostrets arteriella hemodynamik.
- Om fostrets hemodynamik är oförändrad förbereds kroppen för förlossning med hjälp av östrogener, intracervikal administrering av prostaglandin E2-gel med dynamisk CTG-kontroll (dagligen) och övervakning av fostrets blodflöde (var tredje dag).
- När centralisering av blodcirkulationen detekteras indikeras en studie av venöst blodflöde och intrakardiell hemodynamik för att klargöra fostrets kompensationsförmåga och välja metod och tidpunkt för leverans.
- Under graviditeten efter fullgången tid förändras fostrets hemodynamik i etapper:
Steg I - störningar i intraplacenta och fetoplacenta blodflöde. I detta skede finns inga störningar i arteriell och venös hemodynamik hos foster. En ökning av kärlmotståndet noteras i navelsträngsartären och dess terminala grenar, såväl som i spiralartärerna. Indikatorerna för gaskompositionen och syra-bastillståndet i navelsträngsblodet ligger inom normala gränser.
Steg II - centralisering av fostrets cirkulation. Hypoxemi observeras i den nyföddes blod vid födseln. I detta skede bör två på varandra följande steg urskiljas:
- IIa - initiala tecken på centralisering av fostrets arteriella cirkulation med oförändrat venöst och intrakardiellt blodflöde;
- IIb - måttligt uttalad centralisering av blodcirkulationen med nedsatt blodflöde i venkanalen och ökad blodflödeshastighet i aortaklaffen.
Stadium III - uttalad centralisering av fostrets cirkulation med nedsatt venöst utflöde och dekompensation av central och intrakardiell hemodynamik. I navelsträngsblodet hos den nyfödda vid födseln - hypoxemi i kombination med acidos och hyperkapni.
- Om en minskad CPC (< 1,1), centralisering av fosterhemodynamiken (initial centralisering: SDO i MCA < 2,80; i Ao > 8,00) med en ökning av den genomsnittliga blodflödeshastigheten i venkanalen (måttlig centralisering: SDO i MCA < 2,80; i Ao > 8,00; Tamx i VP > 32 cm/s), initiala tecken på fosterhypoxi enligt CTG-data detekteras, indikeras intravenös administrering av hesobendin + etamivan + etofillin som prenatal förberedelse för att öka fosterhjärnans adaptiva förmåga.
- Vid initial centralisering (SDO i MCA < 2,80; eller i fosteraorta > 8,00) i närvaro av god biologisk beredskap för förlossning, okomplicerad obstetrisk och gynekologisk anamnes, genomsnittlig fosterstorlek, programmerad förlossning genom den naturliga födelsekanalen efter amniotomi under noggrann hjärtövervakning av fostrets kardiovaskulära system är möjlig. Bristande biologisk beredskap för förlossning, försämrad obstetrisk och gynekologisk anamnes, stor fosterstorlek dikterar behovet av planerat kejsarsnitt.
- Vid måttligt uttryckt centralisering av fostrets hemodynamik (SDO i MCA < 2,80 och i aorta > 8,00; Tamx i VP > 32 cm/s) på grund av spänningen i alla fostrets kompensationsmekanismer och avsaknaden av reservkapacitet för förlossning, indikeras förlossning med kejsarsnitt planerat.
- Detektion av störningar i både arteriella och venösa kanaler för fostrets blodflöde (markant centralisering: SDO i MCA < 2,80 och i aorta > 8,00; i VPr S/A > 2,25, PIV > 1,00; i IVC %R > 16%, PIV > 1,2) i kombination med måttlig eller svår fosterhypoxi enligt CTG-data indikerar dekompensation av fostrets hemodynamik och kräver akut kejsarsnitt.
Förebyggande
- Identifiering av en riskgrupp för graviditet efter fullgången tid bland kvinnor som söker mödravård.
- Förebyggande av placentainsufficiens och förstorat foster.
- Noggrann beräkning av graviditetsperioden och födelsedatum, med hänsyn till datumet för den sista menstruationen (vid regelbunden menstruationscykel) och en ultraljudsundersökning utförd före 20 veckors graviditet.
- Snabb sjukhusvistelse av en gravid kvinna för att förbereda födelsekanalen för förlossning och bedöma fostrets tillstånd.
Prognos
Med snabb och grundlig bedömning av fostrets tillstånd och adekvata obstetriska taktiker är prognosen gynnsam. Indikatorerna för barns fysiska och neuropsykiska utveckling skiljer sig inte från de vid okomplicerade, snabba förlossningar. Men med utveckling av komplikationer, särskilt svår fosterhypoxi, förlossningstrauma och mekoniumaspiration, är prognosen mindre gynnsam. Perinatala förluster är upp till 7 %, hypoxisk-ischemisk skada på centrala nervsystemet - upp till 72,1 %.


 [
[