Medicinsk expert av artikeln
Nya publikationer
Rabies hos barn
Senast recenserade: 04.07.2025

Allt iLive-innehåll är mediekontrollerat eller faktiskt kontrollerat för att säkerställa så mycket faktuell noggrannhet som möjligt.
Vi har strikta sourcing riktlinjer och endast länk till välrenommerade media webbplatser, akademiska forskningsinstitut och, när det är möjligt, medicinsk peer granskad studier. Observera att siffrorna inom parentes ([1], [2] etc.) är klickbara länkar till dessa studier.
Om du anser att något av vårt innehåll är felaktigt, omodernt eller på annat sätt tveksamt, välj det och tryck på Ctrl + Enter.
Rabies, eller hydrofobi, är en akut virussjukdom som överförs genom bett av ett infekterat djur, med skador på nervsystemet och utveckling av svår encefalit med dödlig utgång.
Epidemiologi
Rabiesviruset, som varit ett folkhälsoproblem sedan urminnes tider, orsakar för närvarande cirka 59 000 dödsfall varje år, varav nästan alla överförs via hundbett. Detta har en betydande ekonomisk inverkan på utvecklingsländer, särskilt i Afrika och Asien, som kan bära minst sådana förluster. Trots sin nästan 100-procentiga dödlighet är hundrabies en helt förebyggbar sjukdom, och historiska exempel på utrotning av hundrabies i den utvecklade världen vittnar om detta. [ 1 ]
Orsaker rabies
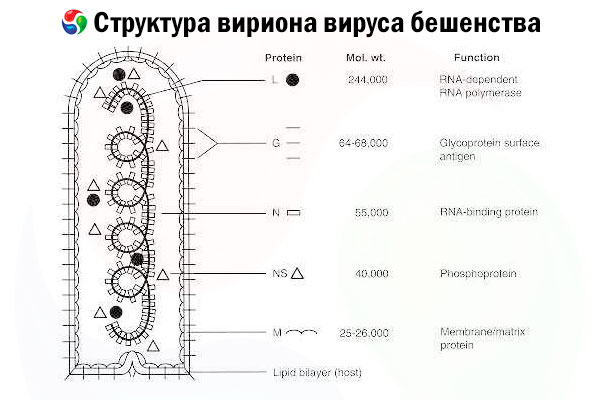
Det orsakande agenset är rabiesviruset (RV), ett negativt RNA-virus i rabdovirusfamiljen, ungefär 60 nm × 180 nm i storlek.
Den består av en inre proteinkärna, eller nukleokapsid, innehållande nukleinsyra, och ett yttre membran, ett lipidinnehållande dubbellager täckt med transmembrana glykoproteinspikar. Den har en relativt enkel modulär genomstruktur och kodar för fem strukturella proteiner:
- RNA-beroende RNA-polymeras (L),
- nukleoprotein (N),
- fosforylerat protein (P),
- matrisprotein (M) och
- glykoprotein (G) på yttre ytan.
N-, P- och L-proteinerna bildar tillsammans med det genomiska RNA:t ribonukleoproteinkomplexet. G är det enda RV-antigenet som kan inducera produktionen av RV-neutraliserande antikroppar, vilka är de viktigaste immuneffektorerna mot dödlig RV-infektion. Å andra sidan har ribonukleoproteinkomplexet visat sig vara det viktigaste RV-antigenet som kan inducera CD4+ T-celler, vilket kan öka produktionen av RV-neutraliserande antikroppar genom intrastrukturell antigenigenkänning.[ 2 ] Ribonukleoproteinkomplexet kan spela en viktig roll i upprättandet av immunologiskt minne och långsiktig immunitet.[ 3 ]
Klassificering och antigentyper
Släktet Lyssavirus omfattar rabiesvirus och antigeniskt och genetiskt besläktade rabiesvirus: Lagos-, Mokola- och Duvenhage-fladdermusvirus, samt två förmodade subtyper av europeiska fladdermuslyssavirus. Korsskyddsstudier indikerar att djur som immuniserats med traditionella rabiesvacciner kanske inte är helt skyddade när de utsätts för andra lyssavirus.
Rabiesvirus kan klassificeras som fixerade (anpassade genom passage i djur eller cellkultur) eller gatuvirus (vildtyp). Användningen av monoklonala antikroppar och genetisk sekvensering för att differentiera gaturabiesvirus har hjälpt till att identifiera virusvarianter som härrör från stora värdreservoarer världen över och att föreslå sannolika källor till mänsklig exponering när en historia av ett definitivt djurbett annars saknades hos en patient.[ 8 ]
Patogenes
Den huvudsakliga smittkällan och infektionskällan bland vilda djur är vargar, rävar, schakaler, fladdermöss, och bland husdjur - hundar och katter, i sällsynta fall - hästar, nötkreatur, grisar, råttor etc. Överföring av smitta från person till person, även om möjlig, är extremt sällsynt. Detta är en typisk zoonotisk infektion. Människor smittas med rabies främst från hundar.
Efter att en människa blivit biten av ett sjukt djur, förökar sig viruset i muskelvävnaden vid bettstället, och sedan, efter att ha nått ändarna av de sensoriska perifera nerverna, sprider sig det centripetalt och når motorneuronerna. Den tid det tar för viruset att röra sig och hjärnan att påverkas beror på bettstället. Vid svåra bett i huvudet och ansiktet kan viruset nå centrala nervsystemet på 15–20 dagar, och vid mindre skador på huden på bålen och lemmarna och följaktligen en liten dos av patogenen, kan processen att överföra viruset till centrala nervsystemet fördröjas i flera månader eller till och med upp till 1–1,5 år. När viruset når centrala nervsystemet fixeras det i hjärnans och ryggmärgens vävnader, främst i neuronerna i medulla oblongata, ammoniumhornet och hjärnbasen. I ryggmärgen är de bakre hornen mest drabbade. Från centrala nervsystemet når viruset centrifugalt längs nervstammarna spottkörtlarna, där det förökar sig och utsöndras med saliven.
Begrepp inom patogenesen av rabies
RV har ett brett värdspektrum och kan infektera nästan alla däggdjur. Även om flera överföringsvägar för RV har rapporterats, sker naturlig infektion oftast via ett bett. Förutom bett kan konsumtion av RV-infekterade kadaver främja rabiesvirusinfektion hos fjällrävar, och kontakt mellan RV och slemhinnor har visat sig vara en annan möjlig överföringsväg.[ 9 ] Under vissa ovanliga omständigheter, såsom oavsiktlig utsläpp av RV som en aerosol i ett laboratorium eller RV som en aerosol i grottor som bebos av ett stort antal fladdermöss,[ 10 ] kan aerosolöverföring förekomma.
Det är ännu inte klart om gatu-RV-stammar och musanpassade eller vävnadskulturanpassade RV-stammar replikerar vid inympningsstället innan de kommer in i CNS. Medan experimentell intramuskulär infektion av unga hamstrar eller tvättbjörnar med gatu-RV avslöjade RV-replikation i strimmiga muskelceller innan viruset invaderade motorneuronaxoner över neuromuskulära förbindelser,[ 11 ],[ 12 ] visade intramuskulär infektion av möss med musanpassad CVS-24 RV att RV migrerar direkt till CNS utan föregående replikation vid inympningsstället.[ 13 ] Väl i terminalerna av omyeliniserade axoner transporteras RV retrogradt till cellkroppen.
Nyligen genomförda rön tyder på att axonal vesikeltransport kan representera en nyckelstrategi för långdistansförflyttning av virioner i axoner.[ 14 ] Det har uppskattats att RV migrerar inom axoner med en hastighet av 3 mm/h.[ 15 ] Infektionen sprider sig sedan genom en kedja av neuroner som är sammankopplade med synaptiska förbindelser. Den exakta mekanismen som främjar transsynaptisk spridning är dock fortfarande okänd. Efter att ha infekterat hjärnan sprider sig viruset centrifugalt till det perifera och autonoma nervsystemet i många perifera organ.[ 16 ] I det sista steget av infektionscykeln migrerar RV till spottkörtlarna; efter replikering i mukogena acinära celler frigörs det i saliven och är redo för överföring till nästa värd.[ 17 ]
När det gäller rabiesvirusinducerad patologi har apoptotisk celldöd föreslagits som en potentiell patogen mekanism i experimentella rabiesmodeller av möss infekterade med en fixerad stam av RV.[ 18 ] En patogen mekanism som kan bidra till den djupa CNS-dysfunktionen som är karakteristisk för rabies kan vara nedsatt neuronal funktion. Genuttryck har visat sig vara markant reducerat i RV-infekterade neuroner, vilket resulterar i en generell hämning av proteinsyntesen,[ 19 ] och flera studier har visat nedsatt neurotransmission efter RV-infektion. Jiang visade att bindning av en acetylkolinreceptorantagonist till infekterade råtthjärnhomogenat var reducerad jämfört med kontroller.[ 20 ] Nedsatt frisättning och bindning av serotonin, en neurotransmittor involverad i kontrollen av sömncykeln, smärtuppfattning och beteende, observerades också i RV-infekterad råtthjärna. [ 21 ], [ 22 ] Förutom att påverka neurotransmissionen kan högerkammarinfektion också påverka jonkanaler. Infekterade musneuroblastomceller uppvisar minskat funktionellt uttryck av spänningsstyrda natriumkanaler, vilket kan förhindra aktionspotentialer och i slutändan leda till funktionell försämring. [ 23 ]
Förutom avsaknaden av allvarliga patologiska lesioner i CNS, framkallar de flesta fall av mänsklig rabies inte ett immunsvar 7 till 10 dagar efter de kliniska tecknen. Dessa djupgående skillnader mellan patogenesen för rabies och den för de flesta andra virala eller bakteriella CNS-infektioner stöds ytterligare av det faktum att immunsuppression antingen är ineffektiv eller skadlig för resultatet av rabies. [ 24 ] Den låga nivån av immunsvar som ofta observeras hos rabiesoffer är förbryllande eftersom den inte kan förklaras av den dåliga immunogeniciteten hos RV-antigener. Faktum är att RV G och nukleokapsidprotein är potenta B- och T-cellsantigener när de administreras parenteralt. [ 25 ] En möjlig förklaring till den låga graden av immunsvar mot RV hos människor eller djur med rabies kan vara att RV-infektion i CNS orsakar immunsuppression, [ 26 ] och det har föreslagits att RV använder en subversiv strategi inklusive att förhindra apoptos och förstöra invaderande T-celler. [ 27 ]
Försvagade RV-stammar som har anpassats till icke-neuronala celler skiljer sig avsevärt från patogena gatu-RV-stammar i sin neuroinvasivitet, vilket hänvisar till deras förmåga att invadera CNS från perifera platser. I detta avseende saknar vävnadskulturanpassade RV-stammar eller har endast begränsad förmåga att invadera CNS från perifera platser, medan gatu-RV-stammar eller musanpassade RV-stammar som CVS-24 är mycket invasiva.[ 28 ] Viktiga faktorer involverade i RV-neuroinvasion inkluderar virusupptag, axonal transport, transsynaptisk spridning och virusreplikationshastighet.
Fram tills nyligen var vår kunskap om rabiespatogenes begränsad och baserades främst på beskrivande studier av gatu-rv-stammar eller experimentella infektioner med försvagade stammar anpassade i laboratoriet. Tillkomsten av omvänd genetik har gjort det möjligt för oss att identifiera de virala element som bestämmer den patogena fenotypen hos rabies och att bättre förstå de mekanismer som är involverade i rabiespatogenes.
Identifiering av virala element som kontrollerar förvärv, spridning och replikation av rabiesvirus
- Virala element involverade i virusinfångning
RV-infektion börjar med att viruset fäster vid en förmodad cellulär receptor. Även om flera membranytemolekyler har föreslagits som RV-receptorer, inklusive nikotinacetylkolinreceptorn,[ 29 ] den neurala celladhesionsmolekylen[ 30 ] och den lågaffinitetsneurotrofinreceptorn p75 NTR,[ 31 ] är det fortfarande oklart om dessa molekyler faktiskt spelar en roll i rabiesvirusets livscykel. I detta sammanhang har det nyligen visats att RV G–p75 NTR-interaktionen inte krävs för RV-infektion av primära neuroner.[ 32 ] Efter receptorbindning internaliseras RV via adsorptiv eller receptormedierad endocytos. [ 33 ] Den låga pH-miljön i det endosomala utrymmet inducerar sedan konformationsförändringar i RV G som utlöser fusion av virusmembranet med det endosomala membranet, varigenom RNP frisätts i cytoplasman. [ 34 ] För virus spelar RV G en avgörande roll i virusupptaget, troligen genom interaktioner med förmodade cellulära receptorer som underlättar snabbt upptag. I detta avseende har det visats att patogeniciteten hos vävnadskulturanpassade RV-stammar (t.ex. ERA, HEP och CVS-11) korrelerar med närvaron av en determinant belägen i antigenställe III hos G-proteinet. [ 35 ] En Arg → Gln-mutation vid position 333 i detta antigenställe hos ERA G-proteinet resulterade i en sjufaldig fördröjning av internaliseringen av Gln333 RV-varianten jämfört med vildtypsvarianten. Asn194→Lys194-mutationen i RV G, som förklarar återuppkomsten av den patogena fenotypen, var associerad med en signifikant minskning av internaliseringstiden.[ 36 ] Dessutom visade experiment med chimära RV att den tid som krävdes för internalisering av RV-virioner ökade signifikant och patogeniciteten minskade kraftigt efter att G-genen från den högpatogena SB RV-stammen, som härleddes från en cDNA-klon av den silver-deriverade fladdermusassocierade stammen RV-18,[ 37 ] ersattes med den från den högförsvagade SN-stammen, som isolerades från en cDNA-klon av SAD B19 RV-vaccinstammen.[ 38 ] Tillsammans stöder dessa data uppfattningen att kinetiken för virusupptag, som är en funktion av RV G, är en viktig avgörande faktor för RV-patogenicitet.
- Virala element involverade i spridning och överföring av virus
En unik egenskap hos rabiesvirus är dess förmåga att spridas från cell till cell. Observationen att Gln333 ERA-varianten förlorar pH-beroende cell-cell-fusionsaktivitet in vitro [ 39 ] och uppvisar en kraftigt minskad förmåga att spridas från cell till cell [ 40 ] tyder på att RV G också spelar en nyckelroll i cell-till-cell-spridning och därmed virusöverföring, troligen genom dess fusiogena aktivitet. Denna möjlighet stöds ytterligare av upptäckten att spridningshastigheten för den patogena RV-revertanten SPBNGAK är nästan dubbelt så hög som den som bestämts för den icke-patogena SPBNGA-varianten. Intressant nog orsakade Asn 194 → Lys 194-mutationen i G SPBNGAK en förskjutning av pH-tröskeln för membranfusion till ett högre pH, vilket stöder hypotesen att en högre pH-tröskel för membranfusion är associerad med ökad virusspridning. [ 41 ]
Studier av transneuronala indikatorer på RV-infektion hos råttor [ 42 ] och rhesusapor [ 43 ] har visat att rabiesvirus migrerar uteslutande i retrograd riktning i axoner. Även om flera RV-proteiner är involverade i neuronala transportmekanismer, verkar RV G spela en dominerande roll i transneuronal spridning av RV-infektion. Till exempel, medan perifer infektion med equine infectious anemia virus (EIAV) pseudotypad med RV G resulterar i virusöverföring till ryggmärgen, misslyckades samma EIAV pseudotypad med vesikulärt stomatitvirus G att komma in i nervsystemet. [ 44 ] Dessutom fann man att virusspridningen av ERA G Arg 333 → Gln 333-mutanten i CNS var starkt reducerad jämfört med vildtypsmutanten, vilket ytterligare tyder på en funktion av intakt RV G i transsynaptisk spridning. Det mest övertygande beviset för en viktig roll för RV G i transsynaptisk transport kommer dock från intrakraniell infektion av möss med ett rekombinant G-bristfälligt RV-virus, vilket visade att infektionen förblev begränsad till neuroner vid inokuleringsstället utan några tecken på spridning till sekundära neuroner.[ 45 ] Det är dock troligt att förutom RV G spelar RV M också en roll i virusspridning och därmed i transsynaptisk transport. I detta avseende visades det att spridningen av den chimära SN-BMBG RV-varianten, som innehåller både M och G från den högpatogena SB, var signifikant högre än spridningen av den chimära SN-BG- eller SN-BM-varianten, som innehåller G respektive M från SB, vilket tyder på att optimal interaktion mellan M och G kan spela en viktig roll i virusspridning från cell till cell. [ 46 ] Eftersom RV M stöder virusknoppning, [ 47 ] är det troligt att den mer effektiva spridningen av den chimära RV SN-BMBG-varianten beror på optimal virusknoppning vid det postsynaptiska membranet.
Nyligen genomförda studier har visat att interaktionen mellan RV P och den lätta dyneinkedjan länkar RV RNP till värdcellens transportsystem, vilket underlättar retrograd axonal transport av viruset.[ 48 ],[ 49 ] Emellertid visade perifer infektion av vuxna möss att deletion av LC8-bindningsdomänen hos RV P inte förhindrar virusets inträde i CNS, vilket tyder på att RV-proteinet inte är direkt involverat i retrograd axonal spridning av RV.[ 50 ]
- Virala element som kontrollerar viral replikation
Till skillnad från många andra virus, såsom influensavirus, är RV-patogeniciteten omvänt proportionell mot hastigheten för viral RNA-syntes och produktion av infektiösa viruspartiklar. Jämförelse av viralt mRNA och genomiskt RNA-nivåer producerade av olika chimära virus tyder på att viral RNA-transkription och replikation regleras av flera faktorer, inklusive RV M, som har identifierats som en transaktiv faktor som medierar övergången från initialt höga nivåer av mRNA-syntes till genomiskt RNA-syntes.[ 51 ] Dessutom kan M från alla rabdovirus stänga av viralt genuttryck genom att binda till RNP, vilket resulterar i bildandet av en mycket kondenserad ryggradsliknande struktur som inte kan stödja RNA-syntes.
För att identifiera andra virala element som kontrollerar patogenicitet genom att reglera viral replikation, ersattes de 5'-terminala sekvenserna av den högpatogena SB-stammen stegvis med sekvenser från den högförsvagade SN-vaccinstammen, vilket resulterade i rekombinanta virus SB2 (terminal sekvens [TS] + L), SB3 (TS + L + pseudogen [Ψ]), SB4 (TS + L + Ψ + G) och SB5 (TS + L + Ψ + G + M). Intramuskulär infektion med de ursprungliga SB- och SN-virusen och de chimära RV:erna SB2, SB3, SB4 och SB5 framkallade de högsta dödlighetsgraderna hos SB-infekterade möss och ingen morbiditet eller mortalitet hos SN-infekterade möss. Ersättning av TS, L och SB med motsvarande element från SN resulterade i en blygsam minskning av morbiditet och mortalitet, och ett ytterligare G- eller G- plus M-utbyte minskade kraftigt eller eliminerade helt viral patogenicitet.
Fenotypisk karakterisering av dessa vildtyps- och chimära RV i vävnadskultur visade att patogeniciteten hos en given RV är omvänt korrelerad med dess förmåga att replikera i neuronala celler. Även om SB replikerades vid nivåer nästan 1000 gånger lägre än SN, och ersättning av TS, L och i SB med SN-nivåer hade liten effekt på viral tillväxtkinetik, resulterade ytterligare ersättning av G eller G plus M i SB med motsvarande SN-gener i en 1-log ökning av virusproduktionen, vilket tyder på att viralt RNA-replikationskinetik såväl som viral partikelproduktion till stor del kontrolleras av RV G-proteinet. Denna slutsats stöds av data erhållna med RV G-varianter som skiljer sig med en aminosyra i deras G-proteiner. Den patogena rabiesvirusvarianten SPBNGAK 194 producerade en virustiter i NA-celler som var 1 log lägre än den som producerades av den icke-patogena varianten SPBNGAN 194, och realtids-PCR-analys visade att hastigheterna för viralt RNA-transkription och replikation i SPBNGAK-infekterade NA-celler var 5- och 10-faldigt högre än i SPBNGAK-infekterade NA-celler.[ 52 ] Ytterligare bevis för en invers korrelation mellan patogenicitet och hastigheten för viralt RNA-syntes och viral partikelproduktion tillhandahölls av möss infekterade med chimära rekombinanta virus där G- och M-generna från den försvagade SN-stammen ersattes med de från den högpatogena SB-stammen. Dessa experiment visade en signifikant ökning av patogeniciteten hos den föräldra-SN-stammen som bar RV G jämfört med den patogena SB-stammen. Patogeniciteten ökade ytterligare när både G och M från SB introducerades i SN.
Substitution av G eller M eller båda i SN med motsvarande gener från SB associerades med en signifikant minskning av hastigheten för viruspartikelproduktion såväl som hastigheten för viral RNA-syntes. Dessa data indikerar att både G och M spelar viktiga roller i RV-patogenesen genom att reglera virusreplikation. Fyndet att substitution av G eller G plus M i SN med G eller G plus M av SB resulterar i en måttlig till stark minskning av viral RNA-transkription respektive replikation, medan substitution av M ensamt i SN med M av SB resulterar i en stark ökning av viral RNA-transkription och replikation, indikerar att RV G också har en viktig reglerande funktion i viral RNA-transkription/replikation antingen ensamt eller genom interaktion med M-proteinet. Mekanismen genom vilken RV G-genen kontrollerar viral RNA-syntes är okänd. Vissa nukleotidsekvenser inom RV G-generna, såsom de som inkluderar kodonerna för Arg333 och Lys 194, har identifierats som mål för cellulära miRNA. Det har visats att måligenkänning av cellulära miRNA kan resultera i positiv eller negativ reglering av virusreplikation. [ 53 ] Arg 333 → Glu 333 eller Lys 194 → Ser 194-substitutioner inom RV G-gensekvensen resulterar i att miRNA-målsekvenser försvinner, vilket i sin tur är förknippat med en signifikant ökning av hastigheten för viral RNA-syntes [Faber M, Thomas Jefferson University, PA, USA, opublicerade data], vilket tyder på att värdcellulära miRNA också spelar en viktig roll i regleringen av RV-replikation, vilket har visats för andra RNA-virus inklusive vesikulärt stomatitvirus och HCV. [ 54 ], [ 55 ]
Reglering av virusreplikation verkar vara en av de viktiga mekanismerna som är involverade i RV-patogenesen. För att undvika immunsvaret och bevara integriteten hos det neuronala nätverket kan patogena RV-stammar, men inte försvagade stammar, reglera deras tillväxthastighet. En lägre replikationshastighet gynnar sannolikt patogena RV-stammar genom att bevara den neuronala struktur som dessa virus använder för att nå CNS. En annan förklaring till den lägre replikationshastigheten för patogena RV är att viruset, för att undvika tidig upptäckt av värdens immunsystem, bibehåller minimala nivåer av uttryck av sina antigener.
Samband mellan RV G-uttryck, apoptos och patogenicitet
Det är välkänt att gaturabiesvirusstammar som är signifikant mer patogena än vävnadskulturanpassade stammar uttrycker mycket begränsade nivåer av G och inte inducerar apoptos förrän sent i infektionscykeln, vilket tyder på att patogeniciteten hos en viss virusstam är omvänt korrelerad med RV G-uttryck och förmågan att inducera apoptos.[ 56 ] Direkta bevis för en korrelation mellan nivån av G-uttryck och omfattningen av apoptos erhölls med den rekombinanta RV SPBNGA-GA, som bar två identiska G-gener och överuttryckte RV G.[ 57 ] Morfologiska studier av neuronala kulturer infekterade med denna rekombinanta RV visade att celldöden ökade signifikant parallellt med RV G-överuttryck och att apoptos är den huvudsakliga mekanismen som är involverad i RV G-medierad död. I synnerhet är minskningen av F-aktinfärgning efter SPBNGA-GA-infektion förenlig med apoptosinducerad depolymerisering av aktinfilament. Dessutom ökade antalet TUNEL-positiva kärnor i SPBNGA-GA-infekterade neuroner signifikant jämfört med det i oinfekterade och SPBNGA-infekterade neuroner. Emellertid är mekanismen genom vilken RV G-genen medierar den apoptotiska signaleringsprocessen fortfarande i stort sett okänd. Det har föreslagits att RV G-uttryck över ett visst tröskelvärde allvarligt stör cellmembranet. Det är högst troligt att apoptotiska celler inte elimineras snabbt i CNS och därför genomgår sekundär nekros. [ 58 ] Å andra sidan kan RV-infektion och i synnerhet överuttryck av RV G-protein leda till pyroptos, en celldödsväg som liknar apoptos som, till skillnad från apoptos, involverar aktivering av caspase 1 och därigenom leder till nekros. [ 59 ] Graden av nekros eller pyroptos som induceras av RV-infektion spelar sannolikt en avgörande roll i induktionen av antiviral immunitet. Medan apoptotiska celler bibehåller sin membranintegritet och inte stimulerar det medfödda immunsvaret, blir nekrotiska celler permeabiliserade och utsöndrar endogena adjuvanser som kan utlösa ett robust medfött immunsvar. [ 60 ]
Eftersom nivån av apoptos/nekros korrelerar med RV-immunogenicitet har det föreslagits att den immunstimulerande effekten av apoptotiska/nekrotiska celler sannolikt bidrar till genereringen av ett skyddande immunsvar. Därför är reglering av RV G-uttryck mycket sannolikt en viktig faktor i rabiespatogenes, eftersom det ger ett sätt för överlevnad och spridning av patogena RV-varianter i nervsystemet utan att orsaka uppenbar neuronal skada och framkalla ett skyddande immunsvar som skulle förhindra infektion.
RV G-uttryck kan regleras på RNA-syntesnivå, posttranslationsnivå eller båda. Nivåerna av RV G som uttrycks av olika chimära RV-varianter har visat sig återspeglas av hastigheten för viral RNA-syntes, vilket tyder på att differentiell reglering av RV G-uttryck av dessa varianter är resultatet av variationer i hastigheten för viral mRNA-transkription. Liksom med virala RNA-transkriptionshastigheter korrelerar mängden RV G som uttrycks av dessa varianter omvänt med viral patogenicitet. Å andra sidan resulterade infektion av primära neuronala kulturer med den mindre patogena RV-varianten CVS-B2c i fyra gånger högre nivåer av G-protein än infektion med den högpatogena varianten CVS-N2c, trots syntesen av jämförbara nivåer av G mRNA i båda infektionerna. Pulsjaktexperiment visade att de högre G-proteinnivåerna i CVS-B2c-infekterade neuroner till stor del var resultatet av en lägre nedbrytningshastighet av CVS-B2c G-proteinet jämfört med CVS-N2c G-proteinet. Emellertid återstår mekanismen som leder till den snabbare proteolytiska nedbrytningen av CVS-N2c G-proteinet att klargöras.
Symtom rabies
Inkubationstiden för rabies är i genomsnitt 30–90 dagar. Vid massiv infektion genom stora sår i huvud och ansikte kan den förkortas till 12 dagar. I sällsynta fall kan inkubationstiden vara 1 år eller mer.
Det sker en strikt sekventiell förändring av tre perioder av sjukdomen: prodromal, excitation, förlamning.
Prodromalperioden börjar med uppkomsten av värkande eller dragande smärta vid bettstället, samt smärta längs nerverna. I ärrområdet kan det finnas en brännande känsla, klåda, ibland rodnad och svullnad. Patienten upplever allmän sjukdomskänsla, huvudvärk, illamående. Kräkningar, en ökning av kroppstemperaturen till 37,5-38 °C och symtom på en progressiv psykisk störning noteras: ökad reflexmässig excitabilitet, en oförklarlig känsla av ångest, rädsla, melankoli. Ofta är patienten deprimerad, hämmad, tillbakadragen, vägrar att äta, sover dåligt, klagar över dystra tankar, skrämmande drömmar. Prodromalperioden varar 2-3 dagar, ibland förlängs till 7 dagar. I slutet av denna period kan det förekomma ångestattacker med kortvariga andningssvårigheter, en känsla av tryck över bröstet, åtföljd av takykardi och ökad andningsfrekvens.
Upphetsningsperioden kännetecknas av uppkomsten av hydrofobi: när patienten försöker dricka, och sedan vid åsynen av vatten eller en påminnelse om det, upplever hen en krampaktig spasm i svalget och struphuvudet, under vilken hen kastar vattenmuggen med ett skrik, kastar fram darrande händer, kastar bakåt huvudet och kroppen. Nacken sträcks ut, en smärtsam grimas förvränger ansiktet, som blir blåaktigt på grund av spasmer i andningsmusklerna. Ögonen buktar ut, uttrycker rädsla, ber om hjälp, pupillerna vidgas, andningen är svår. Vid attackens höjdpunkt är hjärt- och andningsstopp möjligt. Attacken varar i flera sekunder, varefter patientens tillstånd verkar förbättras. Därefter kan attacker av spasmer i musklerna i struphuvudet och svalget uppstå även från luftrörelser (aerofobi), starkt ljus (fotofobi) eller ett högt ord (akustikofobi). Attackerna åtföljs av psykomotorisk agitation, under vilken patienten beter sig som en "galning". Medvetandet är grumligt under attacken, men klarnar upp under den interiktala perioden. Under agitationsperioden, på grund av ökad tonus i det sympatiska nervsystemet, upplever patienterna en kraftig ökning av salivproduktionen (sialorré) med oförmåga att svälja saliv på grund av spasmer i svalgmusklerna. Patienten sprutar saliv. Vissa patienter kan utveckla tecken på meningism och till och med opistotonus, och kramper är vanliga. I detta fall kan cerebrospinalvätskan inte förändras, men hos vissa patienter kan proteinkoncentrationen öka och antalet celler kan öka på grund av lymfocyter.
Utan adekvat behandling ökar tecken på uttorkning, ansiktsdragen blir skarpare och kroppsvikten minskar. Kroppstemperaturen stiger till höga värden. Kramper är möjliga. Excitationsstadiets varaktighet är cirka 2-3 dagar, sällan 4-5 dagar. Dödlig utgång inträffar vanligtvis under en av attackerna. I sällsynta fall överlever patienten till sjukdomens tredje stadium.
Under förlamningsperioden lugnar patienten ner sig. Attackerna av hydrofobi upphör, patienten kan dricka och svälja mat, medvetandet är klart. Trots det uppenbara välbefinnandet ökar dock letargi, apati, depression, förlamning av extremiteterna, bäckenproblem och förlamning av kranialnerverna uppträder snart. Kroppstemperaturen stiger till 42-43 °C, artärtrycket sjunker och vid slutet av den första dagen inträffar döden på grund av förlamning av hjärt-kärl- och andningscentra.
Neutrofil leukocytos, förhöjt hemoglobin, erytrocyter och hematokrit observeras i perifert blod.
Vad stör dig?
Formulär
Kliniskt skiljer man mellan typiska och atypiska former. Atypiska former inkluderar alla fall utan upphetsning och hydrofobi. Atypiska former inkluderar bulbär, cerebellär, meningoencefalitisk, etc.
Diagnostik rabies
Detektion av rabiesantigen, antikroppar, viralt RNA eller virusisolering möjliggör diagnos av rabies. Eftersom vilket enskilt test som helst kan vara negativt hos en patient med rabies, är det ibland nödvändigt att ta seriella serumprover för detektion av rabiesantikroppar, salivprover för virusodling och hudbiopsi för direkt immunofluorescenstestning för viralt antigen, särskilt vid stark misstanke om rabies.
En av de snabbaste metoderna för att diagnostisera rabies före döden hos människor är att utföra ett direkt immunofluorescenstest på en hudbiopsi i nacken för att detektera rabiesantigen. Det direkta immunofluorescenstestet är den känsligaste och mest specifika metoden för att detektera rabiesantigen i hud och andra färska vävnader (t.ex. hjärnbiopsi), även om resultaten ibland kan vara negativa tidigt i sjukdomen. Om färsk vävnad inte är tillgänglig kan enzymatisk nedbrytning av fixerade vävnader öka immunofluorescenstestets reaktivitet; känsligheten kan dock vara oacceptabelt låg.
Diagnosen kan också fastställas om viruset isoleras från saliv efter inokulering av neuroblastomceller eller laboratoriegnagare; detta är vanligtvis mest effektivt under de första 2–3 veckorna av sjukdomen. Detektion av rabiesvirusneutraliserande antikroppar, vanligtvis utförda med det snabba fluorescerande fokusinhibitionstestet (RFFIT), i serum från ovaccinerade individer är också diagnostiskt. Närvaron av antikroppar i cerebrospinalvätskan bekräftar diagnosen, men de kan uppträda 2–3 dagar senare än serumantikroppar och kan därför vara mindre användbara i sjukdomens tidiga stadier. Medan det serologiska svaret efter vaccination i allmänhet inte kan skiljas från det serologiska svar som induceras av sjukdomen, producerar vaccination vanligtvis inte antikroppar mot cerebrospinalvätskan.
Endast sju fall av rabies-"återhämtning" under de senaste 25 åren har dokumenterats väl. Även om rabiesvirus inte isolerades från någon av patienterna, stödde höga titrar av rabiesneutraliserande antikroppar i serumprover och förekomsten av neutraliserande antikroppar i cerebrospinalvätskan starkt diagnosen.
Vad behöver man undersöka?
Vilka tester behövs?
Differentiell diagnos
Diagnosen rabies hos människor ställs vanligtvis baserat på epidemiologiska och kliniska data och bekräftas i laboratoriet. Diagnosen är enkel om det finns en historia av djurbett och hela spektrumet av symtom och tecken har förekommit. Annars är en noggrann men snabb utvärdering av de epidemiologiska och kliniska egenskaperna hos mindre typiska fall nödvändig innan specifika laboratorietester utförs. Alla patienter med neurologiska tecken eller symtom eller oförklarlig encefalit bör tillfrågas om möjligheten av exponering för djur i rabiesendemiska områden inom eller utanför hemlandet. Att rabies inte misstänktes vid flera nyligen inträffade mänskliga dödsfall i USA kan ha berott på bristande noggrann anamnes på exponering.
Vid sjukdomsdebut kan rabies härma många infektions- och icke-infektionssjukdomar. Många andra encefaliter, såsom de som orsakas av herpesvirus och arbovirus, liknar rabies. Andra infektionssjukdomar kan också härma rabies, såsom stelkramp, cerebral malaria, rickettsios och tyfoidfeber. Paralytiska infektionssjukdomar som kan förväxlas med rabies inkluderar polio, botulism och herpes simian B-encefalit.
Icke-infektiösa sjukdomar som kan förväxlas med rabies inkluderar ett antal neurologiska syndrom, särskilt akut inflammatorisk polyneuropati (Guillain-Barrés syndrom), samt allergisk encefalomyelit efter vaccination sekundär till rabiesvaccination av nervvävnaden, förgiftning eller drogberusning, alkoholabstinens, akut porfyri och rabieshysteri. Guillain-Barrés syndrom kan förväxlas med paralytisk rabies, och vice versa.
Vem ska du kontakta?
Behandling rabies
Behandling för rabies har inte utvecklats. Administrering av stora doser av specifikt antirabiesimmunoglobulin och leukocytinterferon är ineffektivt. Symtomatisk behandling ges för att lindra patientens lidande. För detta ändamål placeras patienten på en separat avdelning eller låda, en skyddande regim skapas som begränsar påverkan av den yttre miljön (minskat buller, starkt ljus, luftflöde). För att minska centrala nervsystemets excitabilitet förskrivs sömntabletter, antikonvulsiva medel och smärtstillande medel. Vattenbalansen normaliseras.
I det paralytiska stadiet förskrivs läkemedel som stimulerar aktiviteten i hjärt-kärlsystemet och andningssystemet. Det rekommenderas att använda hyperbarisk syresättning, cerebral hypotermi, kontrollerad mekanisk andning med fullständig kurarisering av patienten. Emellertid är alla behandlingsmetoder praktiskt taget ineffektiva. I bästa fall är det möjligt att förlänga patientens liv i flera månader. Ett ogynnsamt resultat förutbestäms av svårighetsgraden av skadorna på hjärnstammen med förstörelse av vitala centra.
Förebyggande
Utvecklingen av det första rabiesvaccinet av Pasteur år 1885 inledde en era av mycket effektivare rabiesbekämpning. Idag, trots den nästan 100 % dödligheten hos människor från rabies, är sjukdomen helt förebyggbar genom vaccination före och/eller efter exponering. Medan Pasteur och hans kollegor initierade vaccinationen av privata hundar i Paris, genomfördes den första massvaccinationen av hundar i början av 1920-talet i Japan, vilket markerade det första stora nationella rabiesbekämpningsprogrammet. Oral vaccination av vilda djur, som först utvecklades på 1970-talet, har sedan dess upprepade gånger visat sig effektivt kontrollera sjukdomen hos viktiga landlevande värddjur som rävar, tvättbjörnar och skunkar.[ 68 ] Ihållande rabiesvaccination av reservoardjurspopulationer med 70 % eller högre täckningsgrad kommer så småningom att eliminera RABV från reservoararter och förhindra spridning av viruset till tillfälliga värddjur. [ 69 ]
Fylogenetiska data indikerar att lyssavirus infekterade fladdermöss långt innan de infekterade landlevande däggdjur, och de flesta lyssavirus, inklusive RABV, cirkulerar fortfarande i olika fladdermusarter världen över.[ 70 ] Effektiva metoder för att förhindra överföring av RABV bland fladdermöss är dock fortfarande svårfångade, vilket utesluter möjligheten till fullständig rabiesutrotning vid denna tidpunkt. Men även efter exponering för RABV genom bett av ett rabiesinfekterat däggdjur kan säker och effektiv postexponeringsprofylax (PEP, inklusive sårrengöring, rabiesimmunglobulin och rabiesvaccination) skydda människor från rabiesinfektion om behandling ges snabbt och i enlighet med Världshälsoorganisationens (WHO) rekommendationer.
Dessa två metoder för att förhindra mänskliga dödsfall – en baserad på vaccinering av exponerade personer och den andra baserad på vaccinering av tillräckligt många hundar för att bryta smittcykeln vid källan – är byggstenarna i en "one health"-strategi för att förebygga och kontrollera rabies hos hundar. Dessa två olika sätt att förhindra mänskliga dödsfall betraktades som separata alternativ: Strategi A, baserad på att ge människor PEP, och strategi B, baserad på vaccinering av hundar; eller som komponenter i en kombinerad strategi A + B i en analys av de sannolika kostnaderna för de alternativa strategierna.[ 71 ]
Länder som Thailand har haft enorma framgångar med att förhindra mänskliga dödsfall genom användning av PEP, men har också sett en ökande efterfrågan och därmed sammanhängande kostnader i samband med användningen av enbart PEP. [ 72 ] Till exempel, jämfört med situationen 1991, behövde fyra gånger så många människor (mer än 400 000) PEP år 2003. Nya uppgifter visar att Folkrepubliken Kina, som vaccinerar 15 miljoner människor per år efter potentiell rabiesexponering, spenderar cirka 650 miljoner USD per år enbart på PEP. [ 73 ]
En mycket mer hållbar strategi är att förhindra smittspridning vid källan, i djurpopulationen, samtidigt som tillgången till PEP ökas för exponerade mänskliga patienter vid behov. Där det finns politisk vilja och tillräcklig finansiering för att bekämpa hundrabies kan och har dödsfall eliminerats. Utbredd användning av hundvaccination har lett till att hundrabies eliminerats från flera länder, inklusive Malaysia 1954, [ 74 ] Japan 1956, Taiwan 1961, Singapore, och i synnerhet i hela Västeuropa (granskad i Rupprecht et al, King et al, och Gongal och Wright). [ 75 ]
Использованная литература


 [
[