Medicinsk expert av artikeln
Nya publikationer
Orsaker till och patogenes vid difteri
Senast recenserade: 04.07.2025

Allt iLive-innehåll är mediekontrollerat eller faktiskt kontrollerat för att säkerställa så mycket faktuell noggrannhet som möjligt.
Vi har strikta sourcing riktlinjer och endast länk till välrenommerade media webbplatser, akademiska forskningsinstitut och, när det är möjligt, medicinsk peer granskad studier. Observera att siffrorna inom parentes ([1], [2] etc.) är klickbara länkar till dessa studier.
Om du anser att något av vårt innehåll är felaktigt, omodernt eller på annat sätt tveksamt, välj det och tryck på Ctrl + Enter.
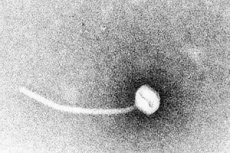
Difteri är ett exempel på toxigena infektionssjukdomar. År 1883 visade Klebs att Corynebacterium diphtheriae var det orsakande medlet för difteri. Ett år senare fann Loeffler att organismen endast kunde odlas från nasofaryngeala håligheten och föreslog att skadorna på inre organ berodde på ett lösligt toxin. År 1888 visade Roux och Yersin att djur som injicerats med sterila filtrat av C. diphtheriae utvecklade organpatologi som inte kunde skiljas från den hos mänsklig difteri; detta visade att ett potent exotoxin var den viktigaste virulensfaktorn.
Difteri är oftast en övre luftvägsinfektion som orsakar feber, halsont och sjukdomskänsla. Ett tjockt, grågrönt fibrinmembran, ett pseudomembran, bildas ofta vid infektionsstället/-platserna som ett resultat av de kombinerade effekterna av bakterietillväxt, toxinproduktion, underliggande vävnadsnekros och värdens immunsvar. Insikten om att systemiska organskador beror på difteritoxinets verkan har lett till utvecklingen av både effektiv antitoxinbaserad behandling för behandling av akut infektion och ett mycket effektivt toxoidvaccin.
Även om toxoidimmunisering har gjort difteri till en sällsynt sjukdom i områden där folkhälsostandarder kräver vaccination, förekommer utbrott av difteri fortfarande hos oimmuniserade och immunsupprimerade grupper. Däremot har utbredda utbrott av difteri som nått epidemiska proportioner inträffat i områden där aktiva immuniseringsprogram har avbrutits.
Andra typer av korynebakterier
Förutom C. diphtheriae, C. ulcerans och C. pseudotuberculosis kan C. pseudodiphtheriticum och C. xerosis ibland orsaka nasofaryngeala och hudinfektioner. De två senare stammarna känns igen på sin förmåga att producera pyrazinamidas. Inom veterinärmedicin är C. renale och C. kutscheri viktiga patogener som orsakar pyelonefrit hos nötkreatur respektive latenta infektioner hos möss.
Orsaker
Det orsakande medlet för difteri, Corynebacterium diphtheriae, är en tunn, lätt böjd stav med klubbformade förtjockningar i ändarna, orörlig; den bildar inte sporer, kapslar eller flageller och är grampositiv.
Förutom toxinet producerar difterikorynebakterier neuraminidas, hyaluronidas, hemolysin, nekrotiserande och diffusa faktorer under sina livsprocesser, vilket kan orsaka nekros och flytandegöring av huvudsubstansen i bindväv.
Baserat på deras förmåga att bilda toxin delas difteri-corynebakterier in i toxigena och icke-toxigena.
Difteritoxin är ett potent bakteriellt exotoxin som bestämmer både allmänna och lokala kliniska manifestationer av sjukdomen. Toxigenet är genetiskt bestämt. Icke-toxigena korynebakterier av difteri orsakar inte sjukdomen.
Enligt kulturella och morfologiska egenskaper delas alla difteri-korynebakterier in i tre varianter: gravis, mitis och intermedius. Det finns inget direkt beroende av sjukdomens svårighetsgrad på varianten av difteri-korynebakterien. Varje variant innehåller både toxigena och icke-toxigena stammar. Toxigena korynebakterier av alla varianter producerar ett identiskt toxin. [ 1 ]
Struktur, klassificering och antigentyper
Corynebacterium diphtheriae är en grampositiv, icke-rörlig, klubbformad stav. Stammar som växer i vävnad eller äldre in vitro-kulturer innehåller fina fläckar i cellväggarna som möjliggör avfärgning under gramfärgning och resulterar i en variabel gramreaktion. Äldre kulturer innehåller ofta metakromatiska granuler (polymetafosfat) som färgas blåaktigt-lila med metylenblått. Cellväggssockerarter inkluderar arabinos, galaktos och mannos. Dessutom kan den toxiska 6,6'-estern av trehalos isoleras, innehållande korynemykol- och korynemykolensyror i ekvimolära koncentrationer. Tre distinkta kulturtyper kännetecknas: mitis, intermedius, gravis.
De flesta stammar kräver nikotinsyra och pantotensyra för tillväxt; vissa kräver även tiamin, biotin eller pimelinsyra. För optimal produktion av difteritoxin måste mediet kompletteras med aminosyror och ställas åt sidan.
Redan 1887 beskrev Loeffler isoleringen av avirulenta (icke-toxigena) C. diphtheriae som var oskiljbara från virulenta (toxigena) stammar isolerade från patienter hos friska individer. Det är nu erkänt att avirulenta stammar av C. diphtheriae kan omvandlas till en virulent fenotyp efter infektion och lysogenisering av en av ett antal distinkta korynebakteriofager som bär den strukturella genen för difteri-toxin, tox. Lysogen omvandling av den avirulenta till virulenta fenotypen kan ske både in situ och in vitro. Den strukturella genen för difteri-toxin är inte essentiell för vare sig korynebakteriofag eller C. diphtheriae. Trots denna observation har genetisk drift av difteri-toxin inte observerats.
Patogenes
Infektionsingångspunkterna är slemhinnorna i orofarynx, näsa, struphuvud, mer sällan slemhinnorna i ögonen och könsorganen, samt skadad hud, sår- eller brännskador, blöjeksem, oläkta navelsår. Vid ingångspunkten förökar sig difteribakterien och utsöndrar exotoxin.
Fibrinogenrikt exsudat utsöndras och omvandlas till fibrin under inverkan av trombokinas som frisätts under nekros av epitelceller. En fibrinös film bildas - ett karakteristiskt tecken på difteri.
Asymptomatisk nasofaryngeal bärare är vanligt i difteriendemiska regioner. Hos mottagliga individer orsakar toxigena stammar sjukdom genom att replikera och utsöndra difteritoxin i nasofarynx eller hudlesioner. Difteritoxinet är ofta täckt av ett pseudomembran bestående av fibrin, bakterier och inflammatoriska celler. Difteritoxin kan proteolytiskt klyvas i två fragment: N-terminalt fragment A (katalytisk domän) och fragment B (transmembran- och receptorbindande domäner). Fragment A katalyserar NAD+-beroende ADP-ribosylering av elongationsfaktor 2, och hämmar därigenom proteinsyntesen i eukaryota celler. Fragment B binder till en cellytereceptor och underlättar leverans av fragment A till cytosolen.
Skyddande immunitet innebär antikroppssvaret mot difteri-toxin efter klinisk sjukdom eller mot difteri-toxin (toxin inaktiverat av formaldehyd) efter immunisering.
Kolonisering
Lite är känt om de faktorer som medierar kolonisering av C. diphtheriae. Det är dock tydligt att andra faktorer än produktion av difteritoxin bidrar till virulens. Epidemiologiska studier har visat att en given lysotyp kan kvarstå i en population under långa perioder. Den kan senare ersättas av en annan lysotyp. Framväxten och den efterföljande dominansen av en ny lysotyp i en population är förmodligen relaterad till dess förmåga att kolonisera och konkurrera effektivt i sitt segment av den nasofaryngeala ekologiska nischen. Corynebacterium diphtheriae kan producera neuraminidas, som klyver cellytans sialinsyra i dess komponenter pyruvat och N-acetylneuraminsyra. Cordefaktor (6,6'-di-O-mykoloyl-α, α'-D-trehalos) är en ytkomponent av C. diphtheriae, men dess roll i koloniseringen av den mänskliga värden är oklar.
Produktion av difteritoxiner
Den strukturella genen för difteritoxin, tox, tillhör en familj av närbesläktade korynebakteriofager, av vilka β-fagen är den bäst studerade. Reglering av difteritoxinuttryck medieras av en järnaktiverad repressor, DtxR, som kodas av C. diphtheriae-genomet. Toxinutryck beror på det fysiologiska tillståndet hos C. diphtheriae. Under förhållanden där järn blir det tillväxtbegränsande substratet dissocierar järn från DtxR, toxicodendrongenen aktiveras och difteritoxin syntetiseras och utsöndras i odlingsmediet med maximal hastighet.
Difteritoxin är ovanligt potent; för mottagliga arter (t.ex. människor, apor, kaniner, marsvin) är så lite som 100 till 150 ng/kg kroppsvikt dödligt. Difteritoxin består av en enda polypeptidkedja med 535 aminosyror. Biokemisk, genetisk och röntgenstrukturanalys visar att toxinet består av tre strukturella/funktionella domäner:
- N-terminal ADP-ribosyltransferas (katalytisk domän);
- en region som underlättar leverans av den katalytiska domänen över cellmembranet (transmembrandomän);
- receptorbindningsdomänen för eukaryota celler.
Efter mild trypsin-digestion och reduktion under denaturerande förhållanden kan difteritoxin specifikt klyvas vid sin proteaskänsliga ögla i två polypeptidfragment (A och B). Fragment A är den N-terminala 21 kDa-komponenten i toxinet och innehåller det katalytiska sätet för ADP-ribosylering av elongationsfaktor 2 (EF-2).
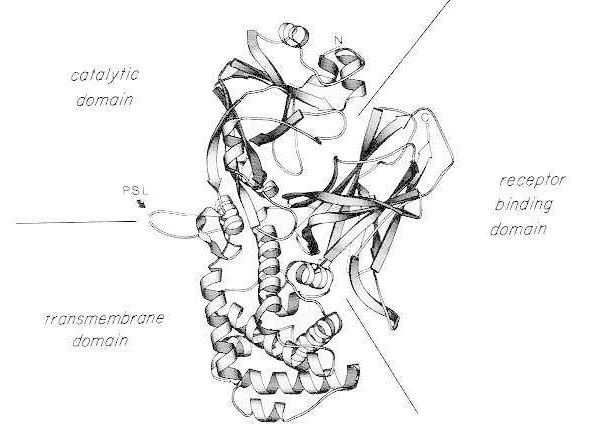
Banddiagram över röntgenkristallstrukturen hos monomeriskt nativt difteritoxin. (modifierad från Bennett MJ, Choe S, Eisenberg D: Domain swapping: Entangling alliances between proteins. Proc Natl Acad Sci, USA, 91: 3127, 1994). De relativa positionerna för de katalytiska, transmembrana och receptorbindande domänerna visas. Det intakta toxinet kan klyvas av trypsinliknande proteaser vid Arg190, Arg192 och/eller Arg193, vilka är belägna i den proteaskänsliga slingan (PSL). Efter reduktion av disulfidbryggan mellan Cys186 och Cys201 kan toxinet upplösas i A- och B-fragment. Aminoterminalen (N) och karboxiterminalen (C) hos det intakta toxinet visas. Remsdiagrammet skapades med hjälp av MOLESCRIPT-programmet.
Det C-terminala fragmentet, fragment B, bär toxinets transmembrana och receptorbindande domäner.
Förgiftning av en enskild eukaryot cell med difteritoxin involverar minst fyra distinkta steg:
- bindning av toxinet till dess receptor på cellytan;
- kluster av laddade receptorer i belagda gropar och internalisering av toxinet via receptormedierad endocytos; efter försurning av den endocytiska vesikeln med en membranassocierad, ATP-driven protonpump,
- införande av transmembrandomänen i membranet och underlättad leverans av den katalytiska domänen till cytosolen, och
- ADP-ribosylering av EF-2, vilket resulterar i irreversibel hämning av proteinsyntesen.
Det har visats att en enda molekyl av den katalytiska domänen som levereras till cytosolen är tillräcklig för att vara letal för cellen.
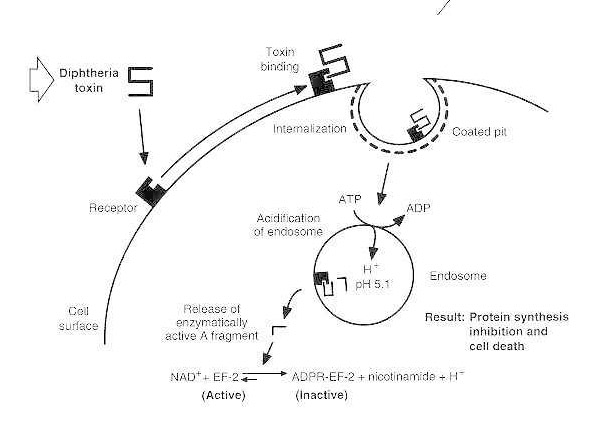
Schematisk bild av difteriförgiftning av en mottaglig eukaryot cell.
Toxinet binder till sin cellytereceptor och internaliseras via receptormedierad endocytos; vid försurning av endosomen infogas transmembrandomänen i vesikelmembranet; den katalytiska domänen levereras till cytosolen, vilket leder till hämning av proteinsyntes och celldöd.
Epidemiologi
Före massimmuniseringen av den amerikanska befolkningen med difteritoxoid var difteri vanligtvis en barnsjukdom. En anmärkningsvärd aspekt av massimmunisering med difteritoxoid är att i takt med att andelen av befolkningen med skyddande nivåer av antitoxinimmunitet (≥ 0,01 IE/ml) ökar, minskar frekvensen av isolering av toxigena stammar från befolkningen. Idag, i USA, där klinisk difteri nästan helt har försvunnit, är isolering av toxigena stammar av C. diphtheriae sällsynt. Eftersom subklinisk infektion inte längre utgör en källa till exponering för difteriantigen och, om den inte förstärks, immuniteten mot antitoxin minskar, har en stor andel vuxna (30 till 60 %) antitoxinnivåer under skyddande nivåer och är i riskzonen. I USA, Europa och Östeuropa har nyligen inträffat utbrott av difteri främst bland individer som missbrukar alkohol och/eller droger. Inom denna grupp har bärare av toxigena C. diphtheriae en måttligt hög nivå av antitoxisk immunitet. Den senaste tidens nedläggning av folkhälsoåtgärderna i Ryssland har lett till att difteri har blivit en epidemi. I slutet av 1994 hade mer än 80 000 fall och mer än 2 000 dödsfall rapporterats i Ryssland.
Fokala utbrott av difteri är nästan alltid förknippade med en immun bärare som har återvänt från en region där difteri är endemisk. Faktum är att nyligen inträffade utbrott av klinisk difteri i USA och Europa har förknippats med resenärer som återvänder från Ryssland och Östeuropa. Toxigena stammar av C. diphtheriae överförs direkt från person till person via luftburna droppar. Det är känt att toxigena stammar direkt kan kolonisera nasofaryngeala håligheten. Dessutom kan den toxigena genen spridas indirekt genom frisättning av toxigena korynebakteriofager och lysogen transformation av icke-toxigena autoktona C. diphtheriae in situ. [ 5 ]
Förutom biotyp- och lysotypbestämning av C. diphtheriae-isolat kan molekylärbiologiska tekniker nu användas för att studera difteriutbrott. Restriktionsendonukleas-digereringsmönster av C. diphtheriae kromosomalt DNA har använts för att studera kliniska utbrott, liksom användningen av klonade korynebakteriella insertionssekvenser som en genetisk sond.
Schick-testet har använts i många år för att bedöma immunitet mot difteritoxin, även om det nu på många områden har ersatts av det serologiska testet för specifika antikroppar mot difteritoxin. I Schick-testet injiceras en liten mängd difteritoxin (cirka 0,8 ng i 0,2 ml) intradermalt i underarmen (teststället) och 0,0124 μg difteritoxin i 0,2 ml injiceras intradermalt i kontrollstället. Avläsningar tas vid 48 och 96 timmar. Ospecifika hudreaktioner når vanligtvis sin topp vid 48 timmar. Vid 96 timmar indikerar en erytematös reaktion med viss nekros vid teststället otillräcklig antitoxisk immunitet för att neutralisera toxinet (≤ 0,03 IE/ml). Inflammation i både test- och kontrollområdet efter 48 timmar indikerar en överkänslighetsreaktion mot antigenpreparatet.
Formulär
Corynebacterium diphtheriae infekterar nasofarynx eller huden. Toxigena stammar producerar ett potent exotoxin som kan orsaka difteri. Symtom på difteri inkluderar faryngit, feber och svullnad i halsen eller området runt hudlesionen. Difteritiska lesioner täcks av ett pseudomembran. Toxinet sprider sig genom blodomloppet till avlägsna organ och kan orsaka förlamning och hjärtsvikt. [ 6 ]
Det finns två typer av klinisk difteri: nasofaryngeal och kutan. Symtom på faryngeal difteri varierar från mild faryngit till hypoxi på grund av luftvägsobstruktion av ett pseudomembran. Engagemang av cervikala lymfkörtlar kan orsaka allvarlig svullnad av halsen (tjurhalsdifteri), och patienten kan utveckla feber (≥ 103°F). Hudskador vid kutan difteri är vanligtvis täckta av ett gråbrunt pseudomembran. Livshotande systemiska komplikationer, främst förlust av motorisk funktion (t.ex. svårigheter att svälja) och hjärtsvikt, kan utvecklas som ett resultat av difteritoxinets verkan på perifera motorneuroner och myokardiet.
Kontrollera
Kontroll av difteri är beroende av adekvat immunisering med difteri-toxoid: difteri-toxin inaktiverat av formaldehyd, vilket förblir antigeniskt intakt. Toxoiden framställs genom att inkubera difteri-toxin med formaldehyd vid 37 °C under alkaliska förhållanden. Difteri-immunisering bör påbörjas under den andra levnadsmånaden med en serie av tre primärdoser med 4 till 8 veckors intervall, följt av en fjärde dos ungefär 1 år efter den sista primärdosen. Difteri-toxoid används ofta som en komponent i difteri-kikhosta-stelkrampsvaccinet (DPT). Epidemiologiska studier har visat att immunisering mot difteri är cirka 97 % effektiv. Även om massimmunisering mot difteri praktiseras i USA och Europa och barnvaccinationsnivåerna är tillräckliga, kan en stor andel av den vuxna befolkningen ha antikroppstitrar under skyddsnivåerna. Vuxna bör revaccineras med difteri-toxoid vart tionde år. En boosterimmunisering med difteri-stelkrampstoxoid bör faktiskt ges till resenärer till områden med hög förekomst av endemisk difteri (Central- och Sydamerika, Afrika, Asien, Ryssland och Östeuropa). Under senare år har användningen av högrenade toxoidpreparat för immunisering minimerat enstaka allvarliga överkänslighetsreaktioner. En boosterimmunisering med difteri-stelkrampstoxoid bör ges till resenärer till områden med hög förekomst av endemisk difteri (Central- och Sydamerika, Afrika, Asien, Ryssland och Östeuropa). Under senare år har användningen av högrenade toxoidpreparat för immunisering minimerat enstaka allvarliga överkänslighetsreaktioner. Boosterimmunisering med difteri-stelkrampstoxoid bör ges till resenärer till områden med hög förekomst av endemisk difteri (Central- och Sydamerika, Afrika, Asien, Ryssland och Östeuropa). Under senare år har användningen av högrenade toxoidpreparat för immunisering minimerat enstaka allvarliga överkänslighetsreaktioner.
Även om antibiotika (såsom penicillin och erytromycin) används som en del av behandlingen av patienter med difteri, är snabb passiv immunisering med difteriantitoxin mest effektiv för att minska dödligheten. Den långa halveringstiden för specifikt antitoxin i blodomloppet är en viktig faktor för att säkerställa effektiv neutralisering av difteri-toxin; för att vara effektivt måste dock antitoxinet reagera med toxinet innan det kan komma in i cellen.
Omstrukturering av difteritoxin för utveckling av eukaryota receptorspecifika cytotoxiner
Proteinteknik är ett nytt och snabbt växande område inom molekylärbiologi. Det kombinerar rekombinant DNA-metoder och fastfas-DNA-syntes för att designa och konstruera chimära gener vars produkter har unika egenskaper. Studier av struktur-funktionsförhållandena hos difteritoxin har tydligt visat att detta toxin är ett protein med tre domäner: katalytiskt, transmembrant och receptormässigt. Det har varit möjligt att genetiskt ersätta den nativa receptorbindande domänen hos difteritoxin med olika polypeptidhormoner och cytokiner (t.ex. α-melanocytstimulerande hormon [α-MSH], interleukin (IL) 2, IL-4, IL-6, IL-7, epidermal tillväxtfaktor). De resulterande chimära proteinerna eller fusionstoxinerna kombinerar cytokinets receptorbindningsspecificitet med toxinets transmembrana och katalytiska domäner. I varje fall visades det att fusionstoxinerna selektivt förgiftade endast de celler som bär motsvarande målreceptor. Det första av dessa genetiskt modifierade fusionstoxiner, DAB 389IL-2, utvärderas för närvarande i kliniska prövningar på människor för behandling av refraktära lymfom och autoimmuna sjukdomar där celler med IL-2-receptorer med hög affinitet spelar en viktig roll i patogenesen.[ 7 ] Administrering av DAB 389 IL-2 visade sig vara säker, vältolererad och kapabel att framkalla varaktig sjukdomsremission utan allvarliga biverkningar. Det är troligt att fusionstoxiner baserade på difteritoxin kommer att bli viktiga nya biologiska medel för behandling av specifika tumörer eller sjukdomar där specifika cellytereceptorer kan riktas in.


 [
[