Medicinsk expert av artikeln
Nya publikationer
Syntes, utsöndring och metabolism av katekolaminer
Senast recenserade: 06.07.2025

Allt iLive-innehåll är mediekontrollerat eller faktiskt kontrollerat för att säkerställa så mycket faktuell noggrannhet som möjligt.
Vi har strikta sourcing riktlinjer och endast länk till välrenommerade media webbplatser, akademiska forskningsinstitut och, när det är möjligt, medicinsk peer granskad studier. Observera att siffrorna inom parentes ([1], [2] etc.) är klickbara länkar till dessa studier.
Om du anser att något av vårt innehåll är felaktigt, omodernt eller på annat sätt tveksamt, välj det och tryck på Ctrl + Enter.
Binjuremärgen producerar föreningar med en struktur som är långt ifrån steroider. De innehåller en 3,4-dihydroxifenyl (katekol)-kärna och kallas katekolaminer. Dessa inkluderar adrenalin, noradrenalin och dopamin beta-hydroxityramin.
Sekvensen för katekolaminsyntesen är ganska enkel: tyrosin → dihydroxifenylalanin (DOPA) → dopamin → noradrenalin → adrenalin. Tyrosin kommer in i kroppen med maten, men kan också bildas från fenylalanin i levern under inverkan av fenylalaninhydroxylas. Slutprodukterna av tyrosinomvandling i vävnader är olika. I binjuremärgen fortsätter processen till stadiet av adrenalinbildning, i ändarna av de sympatiska nerverna - noradrenalin, i vissa neuroner i centrala nervsystemet slutar syntesen av katekolaminer med bildandet av dopamin.
Omvandlingen av tyrosin till DOPA katalyseras av tyrosinhydroxylas, vars kofaktorer är tetrahydrobiopterin och syre. Man tror att detta enzym begränsar hastigheten för hela processen för katekolaminbiosyntes och hämmas av processens slutprodukter. Tyrosinhydroxylas är det huvudsakliga målet för reglerande effekter på katekolaminbiosyntes.
Omvandlingen av DOPA till dopamin katalyseras av enzymet DOPA-dekarboxylas (kofaktor - pyridoxalfosfat), vilket är relativt ospecifikt och dekarboxylerar andra aromatiska L-aminosyror. Det finns dock indikationer på möjligheten att modifiera syntesen av katekolaminer genom att ändra aktiviteten hos detta enzym. Vissa neuroner saknar enzymer för vidare omvandling av dopamin, och det är slutprodukten. Andra vävnader innehåller dopamin beta-hydroxylas (kofaktorer - koppar, askorbinsyra och syre), som omvandlar dopamin till noradrenalin. I binjuremärgen (men inte i ändarna av de sympatiska nerverna) finns fenyletanolamin - ett metyltransferas som bildar adrenalin från noradrenalin. I detta fall fungerar S-adenosylmetionin som en donator av metylgrupper.
Det är viktigt att komma ihåg att syntesen av fenyletolamin-N-metyltransferas induceras av glukokortikoider som kommer in i märgen från cortex via portalvensystemet. Detta kan förklara det faktum att två olika endokrina körtlar är kombinerade i ett organ. Betydelsen av glukokortikoider för syntesen av adrenalin betonas av det faktum att cellerna i binjuremärgen som producerar noradrenalin är belägna runt de arteriella kärlen, medan de adrenalinproducerande cellerna får blod huvudsakligen från de venösa bihålorna som finns i binjurebarken.
Nedbrytningen av katekolaminer sker huvudsakligen under inverkan av två enzymsystem: katekol-O-metyltransferas (COMT) och monoaminoxidas (MAO). De huvudsakliga nedbrytningsvägarna för adrenalin och noradrenalin visas schematiskt i figur 54. Under inverkan av COMT, i närvaro av metylgruppsdonatorn S-adrenosylmetionin, omvandlas katekolaminer till normetanefrin och metanefrin (3-O-metylderivat av noradrenalin och adrenalin), vilka under inverkan av MAO omvandlas till aldehyder och sedan (i närvaro av aldehydoxidas) till vanillylmandelsyra (VMA), den huvudsakliga nedbrytningsprodukten av noradrenalin och adrenalin. I samma fall, när katekolaminer initialt exponeras för MAO snarare än COMT, omvandlas de till 3,4-dioxomandelaldehyd, och sedan, under inverkan av aldehydoxidas och COMT, till 3,4-dioxomandelsyra och VMC. I närvaro av alkoholdehydrogenas kan 3-metoxi-4-oxifenylglykol, som är den huvudsakliga slutprodukten av adrenalin- och noradrenalinnedbrytning i CNS, bildas från katekolaminer.
Nedbrytningen av dopamin är likartad, förutom att dess metaboliter saknar hydroxylgruppen vid beta-kolatomen, och därför bildas homovanillinsyra (HVA) eller 3-metoxi-4-hydroxifenylättiksyra istället för vanillylmandelsyra.
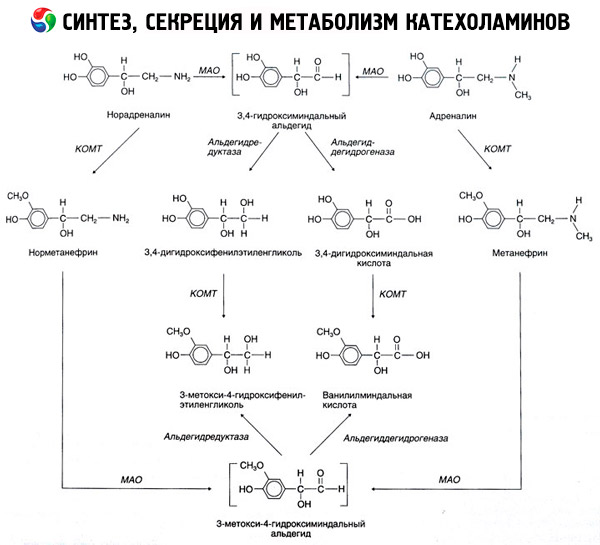
Förekomsten av en kinoid oxidationsväg för katekolaminmolekylen, vilken kan producera mellanprodukter med uttalad biologisk aktivitet, postuleras också.
Noradrenalin och adrenalin som bildas under inverkan av cytosoliska enzymer i de sympatiska nervändarna och binjuremärgen når de sekretoriska granulerna, vilket skyddar dem från nedbrytningsenzymer. Granulernas infångning av katekolaminer kräver energiförbrukning. I binjuremärgens kromaffingranuler är katekolaminerna tätt bundna till ATP (i förhållandet 4:1) och specifika proteiner - kromograniner, vilket förhindrar diffusion av hormoner från granulerna till cytoplasman.
Den direkta stimulansen för utsöndringen av katekolaminer är tydligen penetrationen av kalcium in i cellen, vilket stimulerar exocytos (fusion av granulamembranet med cellytan och deras bristning med fullständig frisättning av lösligt innehåll - katekolaminer, dopamin beta-hydroxylas, ATP och kromograniner - i den extracellulära vätskan).
Fysiologiska effekter av katekolaminer och deras verkningsmekanism
Effekterna av katekolaminer börjar med interaktion med specifika receptorer i målcellerna. Medan receptorer för sköldkörtel- och steroidhormoner är lokaliserade inuti cellerna, finns receptorer för katekolaminer (liksom acetylkolin- och peptidhormoner) på den yttre cellytan.
Det har länge varit fastställt att adrenalin eller noradrenalin är mer effektiva än den syntetiska katekolaminen isoproterenol vid vissa reaktioner, medan effekten av isoproterenol är överlägsen adrenalins eller noradrenalins effekter i förhållande till andra. Baserat på detta utvecklades ett koncept om förekomsten av två typer av adrenoreceptorer i vävnader: alfa och beta, och i vissa av dem kan endast en av dessa två typer vara närvarande. Isoproterenol är den mest kraftfulla agonisten av beta-adrenoreceptorer, medan den syntetiska föreningen fenylefrin är den mest kraftfulla agonisten av alfa-adrenoreceptorer. Naturliga katekolaminer - adrenalin och noradrenalin - kan interagera med receptorer av båda typerna, men adrenalin uppvisar en större affinitet för beta- och noradrenalin - för alfa-receptorer.
Katekolaminer aktiverar hjärtbeta-adrenerga receptorer starkare än beta-receptorer i glatt muskulatur, vilket gjorde det möjligt att dela in beta-typen i subtyper: beta1-receptorer (hjärta, fettceller) och beta2-receptorer (bronker, blodkärl etc.). Effekten av isoproterenol på beta1-receptorer överstiger effekten av adrenalin och noradrenalin endast 10 gånger, medan den på beta2-receptorer verkar 100-1000 gånger starkare än naturliga katekolaminer.
Användningen av specifika antagonister (fentolamin och fenoxibensamin för alfa- och propranolol för beta-receptorer) bekräftade att klassificeringen av adrenoreceptorer är tillräcklig. Dopamin kan interagera med både alfa- och beta-receptorer, men olika vävnader (hjärna, hypofys, kärl) har också sina egna dopaminerga receptorer, vars specifika blockerare är haloperidol. Antalet beta-receptorer varierar från 1000 till 2000 per cell. De biologiska effekterna av katekolaminer medierade av beta-receptorer är vanligtvis förknippade med aktiveringen av adenylatcyklas och en ökning av det intracellulära innehållet av cAMP. Även om receptorn och enzymet är funktionellt sammankopplade är de olika makromolekyler. Guanosintrifosfat (GTP) och andra purinnukleotider deltar i moduleringen av adenylatcyklasaktivitet under inverkan av hormon-receptorkomplexet. Genom att öka enzymaktiviteten verkar de minska beta-receptorernas affinitet för agonister.
Fenomenet med ökad känslighet hos denerverade strukturer har länge varit känt. Tvärtom minskar långvarig exponering för agonister känsligheten hos målvävnaderna. Studien av beta-receptorer har gjort det möjligt att förklara dessa fenomen. Det har visats att långvarig exponering för isoproterenol leder till en förlust av känslighet hos adenylatcyklas på grund av en minskning av antalet beta-receptorer.
Desensibiliseringsprocessen kräver inte aktivering av proteinsyntesen och beror troligen på den gradvisa bildningen av irreversibla hormon-receptorkomplex. Tvärtom åtföljs introduktionen av 6-oxidopamin, som förstör sympatiska ändelser, av en ökning av antalet reagerande beta-receptorer i vävnaderna. Det är möjligt att en ökning av sympatisk nervaktivitet också orsakar åldersrelaterad desensibilisering av blodkärl och fettvävnad i relation till katekolaminer.
Antalet adrenoreceptorer i olika organ kan kontrolleras av andra hormoner. Således ökar östradiol och progesteron minskar antalet alfa-adrenoreceptorer i livmodern, vilket åtföljs av en motsvarande ökning och minskning av dess kontraktila svar på katekolaminer. Om den intracellulära "andra budbäraren" som bildas genom beta-receptoragonisters verkan verkligen är cAMP, är situationen med avseende på överföraren av alfa-adrenerga effekter mer komplicerad. Förekomsten av olika mekanismer antas: en minskning av nivån av cAMP, en ökning av innehållet av cAMP, modulering av cellulär kalciumdynamik, etc.
För att reproducera olika effekter i kroppen krävs vanligtvis doser av adrenalin som är 5-10 gånger mindre än noradrenalin. Även om det senare är mer effektivt i förhållande till α- och beta1-adrenareceptorer, är det viktigt att komma ihåg att båda endogena katekolaminerna kan interagera med både alfa- och beta-receptorer. Därför beror det biologiska svaret hos ett givet organ på adrenerg aktivering till stor del på vilken typ av receptorer som finns i det. Detta betyder dock inte att selektiv aktivering av den nervösa eller humorala länken i det sympatiska binjuresystemet är omöjlig. I de flesta fall observeras ökad aktivitet hos dess olika länkar. Således är det allmänt accepterat att hypoglykemi reflexmässigt aktiverar binjuremärgen, medan en minskning av blodtrycket (postural hypotoni) huvudsakligen åtföljs av frisättning av noradrenalin från ändarna av de sympatiska nerverna.
Adrenoreceptorer och effekterna av deras aktivering i olika vävnader
System, organ |
Adrenerg receptortyp |
Reaktion |
Hjärt-kärlsystemet: |
||
Hjärta |
Beta |
Ökad hjärtfrekvens, konduktivitet och kontraktilitet |
Arterioler: |
||
Hud och slemhinnor |
Alfa |
Minskning |
Skelettmuskler |
Beta |
Expansionskontraktion |
Bukorganen |
Alfa (mer) |
Minskning |
Beta |
Förlängning |
|
Vener |
Alfa |
Minskning |
Andningssystemet: |
||
Bronkiernas muskler |
Beta |
Förlängning |
Matsmältningssystemet: |
||
Mage |
Beta |
Minskade motoriska färdigheter |
Tarmar |
Alfa |
Sammandragning av sfinktrarna |
Mjälte |
Alfa |
Minskning |
Beta |
Avkoppling |
|
Exokrin bukspottkörtel |
Alfa |
Minskad sekretion |
Urogenitala systemet: |
Alfa |
Sfinkterkontraktion |
Blåsa |
Beta |
Avslappning av ejektormuskeln |
Manliga könsorgan |
Alfa |
Ejakulation |
Ögon |
Alfa |
Pupillutvidgning |
Läder |
Alfa |
Ökad svettning |
Spottkörtlar |
Alfa |
Utsöndring av kalium och vatten |
Beta |
Amylasutsöndring |
|
Endokrina körtlar: |
||
Bukspottkörtelns öar |
||
Betaceller |
Alfa (mer) |
Minskad insulinsekretion |
Beta |
Ökad insulinutsöndring |
|
Alfaceller |
Beta |
Ökad utsöndring av glukagon |
8-celler |
Beta |
Ökad utsöndring av somatostatin |
Hypotalamus och hypofysen: |
||
Somatotrofer |
Alfa |
Ökad utsöndring av STH |
Beta |
Minskad utsöndring av STH |
|
Laktotrofer |
Alfa |
Minskad utsöndring av prolaktin |
Tyrotrofer |
Alfa |
Minskad TSH-sekretion |
Kortikotrofer |
Alfa |
Ökad ACTH-sekretion |
| beta | Minskad ACTH-sekretion | |
Sköldkörtel: |
||
Follikulära celler |
Alfa |
Minskad utsöndring av tyroxin |
Beta |
Ökad utsöndring av tyroxin |
|
Parafollikulära (K) celler |
Beta |
Ökad utsöndring av kalcitonin |
Bisköldkörtlar |
Beta |
Ökad utsöndring av PTH |
Njurar |
Beta |
Ökad reninsekretion |
Mage |
Beta |
Ökad utsöndring av gastrin |
BX |
Beta |
Ökad syreförbrukning |
Lever |
? |
Ökad glykogenolys och glukoneogenes med frisättning av glukos; ökad ketogenes med frisättning av ketonkroppar |
Fettvävnad |
Beta |
Ökad lipolys med frisättning av fria fettsyror och glycerol |
Skelettmuskler |
Beta |
Ökad glykolys med frisättning av pyruvat och laktat; minskad proteolys med en minskning av frisättningen av alanin, glutamin |
Det är viktigt att beakta att resultaten av intravenös administrering av katekolaminer inte alltid tillräckligt återspeglar effekterna av endogena föreningar. Detta gäller främst noradrenalin, eftersom det i kroppen huvudsakligen inte frisätts i blodet, utan direkt i synapsklyftorna. Därför aktiverar endogent noradrenalin till exempel inte bara vaskulära alfareceptorer (ökat blodtryck), utan även betareceptorer i hjärtat (ökad hjärtfrekvens), medan tillförsel av noradrenalin utifrån huvudsakligen leder till aktivering av vaskulära alfareceptorer och en reflexmässig (via vagus) nedbromsning av hjärtslaget.
Låga doser adrenalin aktiverar huvudsakligen beta-receptorer i muskelkärl och hjärtat, vilket resulterar i en minskning av perifert kärlmotstånd och en ökning av hjärtminutvolymen. I vissa fall kan den första effekten råda, och hypotoni utvecklas efter administrering av adrenalin. I högre doser aktiverar adrenalin även alfa-receptorer, vilket åtföljs av en ökning av perifert kärlmotstånd och, mot bakgrund av en ökning av hjärtminutvolymen, leder till en ökning av artärtrycket. Emellertid bibehålls även dess effekt på vaskulära beta-receptorer. Som ett resultat överstiger ökningen av systoliskt tryck den liknande indikatorn för diastoliskt tryck (ökning av pulstryck). Med införandet av ännu högre doser börjar adrenalins alfa-mimetiska effekter råda: systoliskt och diastoliskt tryck ökar parallellt, liksom under påverkan av noradrenalin.
Katekolaminers effekt på metabolismen består av deras direkta och indirekta effekter. De förra sker huvudsakligen via beta-receptorer. Mer komplexa processer är associerade med levern. Även om ökad leverglykogenolys traditionellt anses vara ett resultat av beta-receptoraktivering, finns det också bevis för alfa-receptorinvolvering. Indirekta effekter av katekolaminer är associerade med modulering av utsöndringen av många andra hormoner, såsom insulin. I adrenalins effekt på dess utsöndring dominerar den alfa-adrenerga komponenten tydligt, eftersom det har visat sig att all stress åtföljs av hämning av insulinutsöndringen.
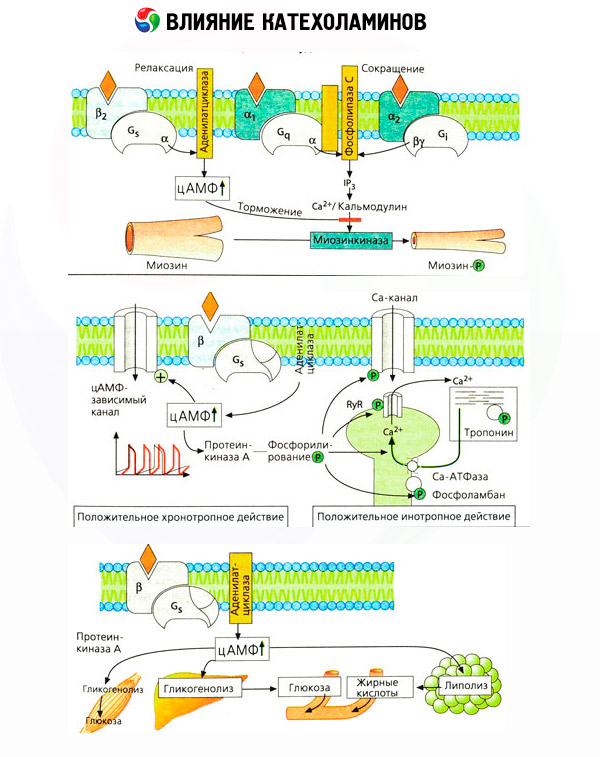
Kombinationen av direkta och indirekta effekter av katekolaminer orsakar hyperglykemi, vilket inte bara är förknippat med ökad leverns glukosproduktion, utan också med hämning av dess användning av perifera vävnader. Accelererad lipolys orsakar hyperlipacidemi med ökad tillförsel av fettsyror till levern och intensifiering av ketonkroppsproduktionen. Ökad glykolys i muskler leder till en ökad frisättning av laktat och pyruvat i blodet, vilka tillsammans med glycerol som frisätts från fettvävnad fungerar som föregångare till leverns glukoneogenes.
Reglering av katekolaminsekretion. Likheten mellan produkterna och reaktionsmetoderna i det sympatiska nervsystemet och binjuremärgen låg till grund för att kombinera dessa strukturer till ett enda sympatiskt-binjuresystem i kroppen med allokering av dess nervösa och hormonella länkar. Olika afferenta signaler är koncentrerade i hypotalamus och ryggmärgens och medulla oblongata centrum, varifrån efferenta signaler härstammar och växlar till cellkropparna hos preganglionära neuroner belägna i ryggmärgens laterala horn i nivå med VIII cervikala - II-III ländryggssegmenten.
De preganglionära axonerna i dessa celler lämnar ryggmärgen och bildar synaptiska förbindelser med neuroner belägna i ganglierna i den sympatiska kedjan eller med celler i binjuremärgen. Dessa preganglionära fibrer är kolinerga. Den första grundläggande skillnaden mellan sympatiska postganglionära neuroner och kromaffina celler i binjuremärgen är att de senare överför den kolinerga signalen som de tar emot inte via nervledning (postganglionära adrenerga nerver), utan via den humorala vägen, och frisätter adrenerga föreningar i blodet. Den andra skillnaden är att postganglionära nerver producerar noradrenalin, medan celler i binjuremärgen huvudsakligen producerar adrenalin. Dessa två ämnen har olika effekter på vävnaderna.

