Medicinsk expert av artikeln
Nya publikationer
Mediciner
Läkemedel som förhindrar trombos och förbättrar blodets reologi
Senast recenserade: 07.07.2025

Allt iLive-innehåll är mediekontrollerat eller faktiskt kontrollerat för att säkerställa så mycket faktuell noggrannhet som möjligt.
Vi har strikta sourcing riktlinjer och endast länk till välrenommerade media webbplatser, akademiska forskningsinstitut och, när det är möjligt, medicinsk peer granskad studier. Observera att siffrorna inom parentes ([1], [2] etc.) är klickbara länkar till dessa studier.
Om du anser att något av vårt innehåll är felaktigt, omodernt eller på annat sätt tveksamt, välj det och tryck på Ctrl + Enter.
För att förebygga bildandet av multipla mikrotromber under chock och deras förstörelse kan olika farmakologiska metoder användas som använder läkemedel som förhindrar trombbildning och förbättrar blodreologin:
- eliminering av systemiska hemodynamiska och mikrocirkulationsstörningar med hjälp av vasoaktiva och inotropa medel;
- åtgärder för att förbättra blodreologin med hjälp av rationell infusionsbehandling och läkemedel som återställer elasticiteten hos erytrocytmembran (trental eller pentoxifyllin);
- förebyggande av trombocytaggregation och bildandet av initiala "vita" tromber i små arteriella kärl med efterföljande initiering av koagulationskaskaden;
- hämning av trombbildning efter aktivering av den systemiska koagulationskaskaden;
- aktivering av fibrinolys med syftet att lösa upp nybildade blodproppar (fibrinolysin, streptokinas, streptodekas, urokinas, etc.) eller tvärtom hämning av fibrinolys när den generaliseras hos vissa patienter med traumatisk chock och sepsis (aminokapronsyra, amben, contracal, etc.).
De flesta av de listade metoderna är traditionella, välutvecklade inom behandling av chock, har sina egna hemorheologiska indikationer och specificeras i relevanta kapitel. Därför är det i detta avsnitt lämpligt att uppehålla sig vid övervägandet av den allmänna metoden för att förebygga trombbildning vid chock med hjälp av farmakologiska medel som påverkar profasen för blodkoagulation. Det är denna nivå av förebyggande av koagulationskomplikationer - förekomsten, bildandet och tillväxten av "vita arteriella tromber" - som lockar forskares största uppmärksamhet.
Olika och ofta multidirektionella störningar i blodkoagulationen med försämrad reologi är karakteristiska för olika typer av chock. Det mest karakteristiska för septisk, endotoxin-, brännskada-, traumatisk och hemorragisk chock är bildandet av multipla mikrotromber i de minsta kärlen, orsakade av störningar i systemisk hemodynamik, vasospasm och mikrocirkulationsstörningar, blodförtjockning, slambildning, minskad elasticitet i erytrocytmembranen, samt många allmänna och lokala faktorer (autokoider) som initierar lokala förändringar i koagulationshemostasen och inkludering av blodkoagulationsprofasen.
I schematisk (förkortad) form presenteras det initiala stadiet av hemokoagulation och mekanismen för lokal hemokoagulationshomeostas enligt följande.
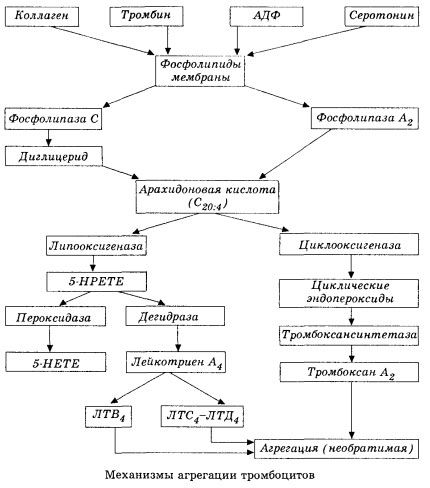
Det börjar med aktiveringen av membranfosfolipas A2 som ett resultat av inverkan av en kombination av skadliga faktorer (direkt membranskada, hypoxi, lipidperoxidation, inverkan av endogena kemiska faktorer, etc.). Som ett resultat av nedbrytningen av membranfosfolipider frigörs icke-förestrade långkedjiga fettsyror, av vilka arakidonsyra är den viktigaste som initialt substrat. Dess transformation (arakidonsyrakaskad) sker via lipoxygenas (syntes av leukotriener) och cyklooxygenas (syntes av prostaglandiner, tromboxaner, prostacyklin) vägar.
De resulterande leukotrienerna (B4, C4, E4, D4, etc.) – substanser med extremt hög biologisk aktivitet, vilka inkluderar den långsamt reagerande substansen vid anafylaxi – är av stor betydelse för initieringen av lokala vaskulära, inflammatoriska och immunreaktioner, inklusive autoimmuna processer. Leukotriener orsakar mikrocirkulationsstörningar, ökad blodkoagulering, frisättning av autolytiska lysosomala enzymer och frisättning i blodet av en faktor som hämmar myokardiell kontraktilitet och bronkial spasm.
På grund av deras förmåga att orsaka kontraktion av glatt muskulatur påverkar leukotriener signifikant systemisk hemodynamik, kranskärl och myokardium, och utövar en kraftfull koronarkonstriktor och negativ inotrop effekt, vilket åtföljs av en minskning av hjärtminutvolymen och spelar en viktig roll i utvecklingen av hypotoni.
Minskad hjärtminutvolym och hypotensiv respons på leukotriener är förknippade med försvagning av hjärtmuskeln och begränsning av venöst återflöde till hjärtat. Av betydande betydelse för att begränsa venöst återflöde är leukotrienernas förmåga att öka kärlväggens permeabilitet och orsaka plasmaextravasation. Leukotriener anses vara viktiga i patogenesen av hjärtinfarkt.
Vid anafylaktisk och septisk (endotoxin) chock ökar deras roll tydligen ännu mer, vilket framgår av leukotrieners förmåga att ackumuleras i betydande mängder i plasma under allergiska reaktioner och att orsaka förändringar i det systemiska blodflödet som är karakteristiska för anafylaktisk chock, liksom de skyddande effekterna av leukotrienreceptorblockerare och lipoxygenashämmare. Utvecklingen av selektiva leukotrienreceptorblockerare bedrivs ganska intensivt och är en lovande vetenskaplig inriktning. Inom detta område har vissa framgångar redan uppnåtts och effektiviteten hos sådana blockerare vid myokardischemi, endotoxin och hemorragisk chock har experimentellt bekräftats. Det kommer dock förmodligen att ta ytterligare flera år innan denna inriktning implementeras kliniskt.
Om tromber bildas i venösa kärl med lika stor deltagande av trombocyter och plasmakoagulationsfaktorer, är trombocyter de huvudsakliga initiatorerna av processen i artärerna. De innehåller ADP, Ca2+, serotonin, fosfolipider, enzymer för prostaglandin- och tromboxansyntes, trombostenin (liksom muskelaktomyosin ger det dessa celler kontraktil förmåga), trombogen tillväxtfaktor i epitel- och muskelceller i kärlväggen och ett antal andra substanser. Humoral reglering av trombocytfunktioner utförs genom specialiserade receptorer i deras membran (alfa2- och beta2-adrenoreceptorer, receptorer för histamin och serotonin, acetylkolin, tromboxan, adenosin och ett antal andra). En speciell egenskap hos trombocyter är en hög affinitet för kollagen och andra subendoteliala element i kärlväggen, för icke-vätande och negativt laddade ytor. Denna egenskap ger trombocyter en exceptionell förmåga att fästa (fastna) på en del av ett kärl med skadat endotel, vilket har god risk att skadas under chock. I detta fall sprider sig trombocyterna ut och frigör pseudopodier, som kan fästa vid varandra och vid kärlväggen. Membranpermeabiliteten ökar, och ADP, serotonin, tromboxan och vissa koagulationsfaktorer som adsorberats på trombocytens yta frigörs från trombocyterna. Dessa ämnen interagerar med motsvarande receptorer på membranet och orsakar, med deltagande av kalciumjoner, aggregation (initialt reversibel). Processen blir självuppehållande, vilket underlättas av humorala reglerande faktorer; andra faktorer kan tvärtom stoppa den och till och med reversera den, vilket orsakar disaggregation.
Med övervägande av trombbildande faktorer och förhållanden ersätts adhesion- och reversibla aggregeringsfaser av den tredje fasen - irreversibel aggregering, som utförs med deltagande av trombostenin och leder till sammandragning av koagulen; reaktionen av förstärkning av aggregatet och sammandragning sker också med deltagande av Ca+, ATP och leder till bildandet av en vit tromb.
Cyklooxygenasvägen för arakidonsyraomvandling i blodplättar, vaskulära endotelceller och andra vävnader säkerställer lokal (metaboliternas halveringstid är mycket kort) koagulationshomeostas, eftersom kraftfulla pro- och antiaggregerande substanser bildas under denna metabolism. Den viktigaste faktorn som aktiverar trombocytaggregation i cyklooxygenaskedjan av reaktioner är tromboxan A2, och dess minst lika kraftfulla antagonist är prostacyklin, som produceras av endotelceller, och i mindre utsträckning prostaglandiner i E- och G-serien. Slutligen påverkas trombocytaggregationen starkt av ytterligare lokala och systemiska humorala faktorer.
Trombocytaggregationsaktivatorer och hämmare
Initiatorer och aktivatorer av trombocytaggregation |
Trombocytaggregationshämmare |
Kollagen |
- |
ADP |
Adenosin och dess stabilisatorer |
Noradrenalin (via alfa2-receptorer) |
Alfa-adrenerga blockerande medel |
Serotonin |
Antiserotoninmedel |
Histamin |
Antihistaminer |
Trombin |
Heparin |
Ca2+ |
Ca2+-antagonister |
CGMP - dess inducerare (acetylkolin?) och stabilisatorer |
CAM - dess inducerare (via beta-adrenerga receptorer) och stabilisatorer (fosfodiesterashämmare) |
Arakidonsyra |
Dextraner, albumin |
Tromboxan A2 |
Prostacyklin I2 |
Farmakologiska interventioner i den initiala fasen av trombbildning vid chock och akuta ischemiska processer i hjärtat och hjärnan tyder på följande möjlighet:
- hämning av initiala reaktioner (totala och partiella) av arakidonsyrakaskaden;
- hämning av en specifik reaktion av tromboxansyntes;
- blockering av receptorer för leukotriener och tromboxaner i blodplättar, glatt muskulatur och andra celler;
- användning av substanser som modulerar trombocytaggregationen, dvs. försvagar på andra sätt den senares reaktion på inverkan av initierande faktorer (kollagen, tromboxan A2, leukotriener, etc.).
Genomförandet av de listade metoderna för korrigering av störningar i blodets reologiska egenskaper möjliggör lösningen av den huvudsakliga taktiska uppgiften: att skydda receptorer för aggregation och adhesion av trombocyter från effekten av aktivatorer eller att undertrycka intracellulära syntesmekanismer för dessa receptorer. Hämning av initiala reaktioner i arakidonsyrakaskaden kan uppnås genom att skydda trombocytreceptorer som reagerar på polymeraktivatorer, med hjälp av lågmolekylära dextraner, vars molekyler konkurrerar med fibrin, kollagen, aggregerat immunoglobulin (IgE) och komponenter i komplementsystemet.
Genom att maskera receptorerna på trombocytmembranet och konkurrera med storskaliga proteiner på ytan av erytrocyter, förskjuter lågmolekylära dextraner dem och förstör bryggorna mellan cellerna. Detta beror på att dextraner, som omsluter det vaskulära endotelet och ytan av blodcellselement, ökar sin negativa laddning och därigenom förstärker antiaggregationsegenskaperna.
Dextraner
Lågmolekylära dextraner minskar kollagen- och ADP-inducerad trombocytaggregation, såväl som trombins aktiverande effekt på trombocyter, hämmar tillväxten av den initiala vita tromben, förbättrar blodflödet, minskar den postoperativa ökningen av plasmafibrinogeninnehållet och förändrar fibrins struktur och stabilitet.
Intravenösa infusioner av dextraner vid trauma och chock minskar inte bara trombocytaggregation och adhesion, utan mobiliserar även endogent heparin, vilket främjar bildandet av en lös och svåråtkomlig blodpropp, som lätt lyseras av fibrinolytika. Antitrombinaktiviteten hos lågmolekylära dextraner är förknippad med deras specifika effekt på strukturen och funktionen av blodkoagulationsfaktor VIII. Faktor VIII (antihemofilt globulin), en stor molekyl med en komplex struktur och funktion, är involverad i trombocytaggregation och stabiliteten hos den resulterande koageln. Dextraner stör verkan av faktor VIII, vilket saktar ner trombocytaggregationen och minskar koaglets stabilitet.
Lågmolekylära dextraner är inte riktiga antikoagulantia och deras korrigerande effekt vid hemorheologiska sjukdomar är huvudsakligen förknippad med hemodilution, påfyllning av cirkulerande plasmavolym och förbättring av blodflödet i mikrocirkulationssystemet.
Dextraners förmåga att förbättra blodflödet vid hemodynamiska störningar (chock, blodförlust) beror på en mängd olika faktorer. Förekomsten av en hög, övergående koncentration av polymeren i blodet leder inte bara till "direkt hemodilution", utan skapar också förutsättningar för vätskeflödet från det interstitiella utrymmet till blodomloppet och den efterföljande balanseringen av dextranens osmotiska effekt. Som en konsekvens av hemodilutionen minskar blodets viskositet, det venösa inflödet till hjärtat ökar och hjärtminutvolymen ökar. Tillsammans med dessa effekter bildar dextraner komplex med fibrinogen och har en antilipemisk effekt.
Således bidrar den antiaggregerande effekten och de hemodynamiska effekterna av lågmolekylära dextraner till att minska blodets viskositet, vilket är särskilt viktigt vid låga skjuvhastigheter. Disaggregation av blodkroppar förbättrar det systemiska blodflödet och mikrocirkulationen, särskilt i den venösa delen, där hastighetsgradienterna är lägst. Användningen av lågmolekylära dextranlösningar vid olika typer av chock, under kirurgisk behandling av skador och deras konsekvenser, och sedan under den postoperativa perioden, bidrar till att förhindra hyperkoagulation och minska sannolikheten för trombotiska processer och emboli.
Det bör dock noteras att infusioner av dextranlösningar i vissa fall åtföljs av anafylaktiska och allergiska reaktioner (farliga i närvaro av sensibilisering och anafylaktisk chock). Detta beror på att dextraner, som har en hög molekylvikt och många sidokedjor, kan fungera som ett antigen. För att fastställa individuell känslighet rekommenderas det därför att i förväg administrera intravenöst upp till 20 ml av en lågmolekylär dextranlösning som en hapten (15 % lösning, molekylvikt 1000) och genomföra infusioner av ett plasmasubstitut innan anestesi introduceras.
 [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
[ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
Trombinhämmare
Farmakologiskt skydd av trombocytreceptorer som interagerar med trombocytaktivatorer kan också uppnås med hjälp av medel som konkurrerar med icke-polymera trombocytaktivatorer eller hämmar dem. Sådana medel inkluderar trombinhämmare (heparin och hirudin, ett antal syntetiska hämmare, adrenalinantagonister), alfareceptorblockerare (fentolamin, dihydroergotamin), ADP-antagonister (dipyridamol, adenosin och dess strukturella analoger, fosfokreatin) och serotoninantagonister (metysergid). Endast ett fåtal av de listade medlen används faktiskt för att förebygga och behandla chock av olika ursprung.
Skydd av intracellulära syntesmekanismer för proteinreceptorer som reagerar med aktivatorer av trombocytaggregation och adhesion, och hämning av tromboxansyntesprocesser är möjliga med läkemedel från olika grupper:
- inducerare och stabilisatorer av cATP, prostacyklin och prostaglandin PgE2;
- fosfolipas- och fosfodiesterashämmare.
Intensiv utveckling av speciella trombocythämmande medel började relativt nyligen och har ännu inte lett till tillförlitliga resultat. För närvarande används i klinisk praxis, förutom dextranlösningar, sådana trombocythämmande medel som acetylsalicylsyra, indometacin, dipyradamol, sulfinpyrazon (persantin), prostacyklin (eikoprostenon) och heparin i stor utsträckning för att förhindra bildandet av vita trombocyter.
Icke-steroida antiinflammatoriska läkemedel
Det har fastställts att de farmakologiska effekterna av icke-steroida antiinflammatoriska läkemedel - acetylsalicylsyra och indometacin - beror på deras effekt på metabolismen av eikosanoider (tromboxaner och prostaglandiner). Nästan alla läkemedel i denna grupp hämmar enzymkomplexet känt som prostaglandinsyntetas, och utövar därigenom sina specifika och antiaggregationshämmande effekter.
Acetylsalicylsyra absorberas mycket snabbt efter oral administrering. Produkten av dess hydrolys, salicylsyra, orsakar hämning av trombocytcyklooxygenas, vilket stör omvandlingen av arakidonsyra till prostaglandin O2 och slutligen tromboxan A2. Acetylsalicylsyra hämmar aggregation inducerad av kollagen, ADP, adrenalin och serotonin. Även om dess GG05 är 15 minuter, varar den antiaggregerande effekten i flera dagar, vilket tydligen förklaras av irreversibel hämning av prostaglandinsyntesreaktioner och hämning av trombocytaggregationsfunktionen under hela deras livslängd (6-10 dagar). Tillsammans med hämning av trombocytcyklooxygenas hämmar acetylsalicylsyra i höga doser cyklooxygenas i kärlväggen och samtidigt som hämningen av tromboxan A2-syntes hämmar prostacyklinsyntes i endotelceller. Därför bör acetylsalicylsyra förskrivas som ett antiaggregeringsmedel i små doser (3000-5000 mg/dag), vilket huvudsakligen hämmar trombocytaggregation.
Med tanke på att acetylsalicylsyra blockerar trombocytcyklooxygenas i flera dagar, och endotelcyklooxygenas - högst en dag, är det rationellt att förskriva läkemedlet inte dagligen, utan var 3-4:e dag. Valet av optimal dos acetylsalicylsyra för patienten bör göras individuellt, eftersom patienterna har olika känslighet för läkemedlets trombocythämmande effekt. Hos reaktiva patienter hämmar acetylsalicylsyra i en dos på 0,5 g trombocytaggregationen med 40-50 %, hos hyperreaktiva patienter - helt eller med 80-90 %, och för reaktiva patienter är avsaknaden av en trombocythämmande effekt karakteristisk när man tar samma dos av läkemedlet.
Selektiva tromboxansyntetas-hämmare är imidazol och dess analoger, vilka inte blockerar cyklooxygenas. Dipyridamol, som används i klinisk praxis vid behandling av kronisk ischemisk hjärtsjukdom som en kranskärlsvidgande substans, hämmar liksom imidazol selektivt tromboxansyntetas och förhindrar syntesen av tromboxan A2. Läkemedlet och dess analoger tros även hämma trombocytfosfodiesteras, vilket ökar koncentrationen av cAMP i trombocyter. Utöver detta hämmar dipyridamol aktiviteten av adenosindeaminas och upptaget av adenosin av trombocyter, blockerar absorptionen av serotonin av trombocyter och deras aggregation inducerad av adrenalin och kollagen. Det finns rapporter om svag trombocythämmande aktivitet hos läkemedlet och dess förmåga att i små doser förbättra trombocytaggregationen. Den mest tillförlitliga trombocythämmande effekten kan uppnås med en kombination av dipyridamol och acetylsalicylsyra.
Heparin
Bland antitrombotiska medel är heparin en av de mest effektiva regulatorerna av blodets aggregerade tillstånd, särskilt vid tidig användning. Heparin har en hög negativ laddning och kan interagera med både stora och små joner och molekyler (enzymer, hormoner, biogena aminer, plasmaproteiner etc.), så dess biologiska verkan är ganska brett. Läkemedlet har antitrombin-, antitromboplastin- och antiprotrombineffekter, förhindrar omvandlingen av fibrinogen till fibrin, hämmar koagulering och ökar fibrinolysen.
Mekanismen bakom heparins antikoagulerande verkan är ganska komplex. Det har nu fastställts att heparins antikoagulerande effekter är förknippade med förstärkningen av antitrombin III:s verkan och förbättringen av heparin-antitrombin III-komplexets förmåga att snabbt inaktivera de flesta serinproteaserna i blodkoagulationssystemet. I heparins antitrombotiska effekt är dess förmåga att öka och bibehålla en hög elektronegativ potential i vaskulära intima, vilket förhindrar trombocytadhesion och bildandet av trombocytmikrotromber, av stor betydelse. Heparin hämmar aktivt trombbildning i vener och förhindrar både lokal trombbildning och disseminerad intravaskulär koagulation.
Prostacyklin och dess stabila analoger
Bland trombocythämmande medel är prostacyklin och dess stabila analoger de mest kraftfulla hämmarna av aggregation. Prostacyklins trombocythämmande effekt beror på stimulering av adenylatcyklas och, som en konsekvens, en ökning av koncentrationen av cAMP i blodplättar, en minskning av halten tromboxan, en minskning av halten tromboxan A2 och blockering av dess receptorer. Prostacyklin är instabilt och hydrolyseras snabbt till inaktiva produkter, så det administreras intravenöst genom dropp med en hastighet av 2 till 20 ng/kg per minut i 30-60 minuter upp till 6 gånger per dag.
Prostacyklin har, tillsammans med en stark antiaggregationseffekt, en kraftfull vasodilaterande och bronkvidgande effekt. Läkemedlet vidgar kärlen i hjärnan, hjärtat, njurarna, skelettmusklerna och mesenterikärlen. Under inverkan av prostacyklin ökar koronarblodflödet, energitillförseln till hjärtmuskeln ökar och dess syrebehov minskar. Trots dess instabilitet i kroppen kan kliniskt gynnsamma effekter vara i flera veckor och till och med månader. Mekanismen för en sådan långvarig verkning är ännu inte klarlagd.
Prostacyklin är ett lågtoxiskt läkemedel, men dess användning kan orsaka biverkningar: ansiktsrodnad, huvudvärk, sänkt blodtryck, buksmärtor, anorexi. Tillsammans med prostacyklin är dess syntetiska stabila analoger (iloprost, etc.) lovande hämmare av trombocytaggregation.
Läkemedel som förbättrar blodets viskositet
Störningar i blodets reologiska egenskaper under trauma och chock orsakas inte bara av förändringar i blodplättarnas funktionella aktivitet, utan också av en ökning av blodets viskositet. Blodets strukturella viskositet som ett komplext dynamiskt dispergerat system bestäms till stor del av plasmans viskositet och erytrocyternas förmåga att deformeras. Plasmaviskositeten beror huvudsakligen på koncentrationen av proteiner i blodet. Proteiner med låg molekylvikt, såsom albumin, har liten effekt på plasmaviskositeten, medan proteiner med stora molekyler (fibrinogen, alfa- och gammaglobuliner, andra makromolekyler) ökar den avsevärt.
Vid låga skjuvhastigheter leder adsorptionen av fibrinogen och globuliner på ytan av erytrocyter till bildandet av bryggor mellan intilliggande celler och bildandet av aggregat från erytrocyter. Bildningshastigheten av aggregat är en komplex biofysisk process och beror inte bara på skjuvningens storlek, utan också på erytrocyternas elektrokinetiska egenskaper, koncentrationen, massan och sorptionskapaciteten hos makromolekylerna-aggregatorerna, samt på erytrocyternas form och plasticitet.
Att bibehålla erytrocytmembranets form och mekaniska egenskaper kräver betydande energiförbrukning. Man tror att den energi som produceras i erytrocyter under glykolysen används till fosforylering av spektrin, vilket resulterar i förändringar i proteinets sekundärstruktur och interaktion med angränsande komponenter i det inre membranet. Interaktionen mellan membranets strukturproteiner, spektrin och aktin, spelar en viktig roll i bildandet av erytrocytmembranets mekaniska egenskaper, för att bibehålla en konstant ytarea hos erytrocyten och dess tjocklek under eventuell deformation.
Vid systemiska hemodynamiska och organrelaterade störningar i blodflödet leder ökningen av erytrocytmembranens styvhet och bildandet av erytrocytaggregat till en minskning av erytrocyternas passagehastighet genom kapillärerna, vilket stör blodets gastransportfunktion. Därför bör korrigering av störningar i blodets reologiska egenskaper i chock, tillsammans med förebyggande av erytrocytaggregation, innefatta normalisering av plasma- och blodviskositet, aggregation och deformation av erytrocyter.
Förutom lågmolekylära dextraner är albuminlösningar ett av de effektiva sätten att öka blodets suspensionsstabilitet. Under den sena chockperioden sker generaliserad aggregation av erytrocyter mot bakgrund av en minskning av albuminkoncentrationen i blodplasman och en ökning av koncentrationen av fibrinogen och globuliner, särskilt alfa2-fraktionen, lipoproteiner och lipider. Under dessa förhållanden beror albumins reologiska effekter på två huvudfaktorer: hemodilution och normalisering av förhållandet mellan mikro- och makroglobulära proteiner i plasma. Samtidigt binder albumin fria syror, vars labilisering under trauma och chock stimulerar aggregationen av blodets cellstrukturer och intravaskulär koagulation och kan orsaka fettemboli.
Antichockåtgärder som syftar till att återställa volymen av cirkulerande blod, eliminera vävnadshypoxi och metabolisk acidos, bidrar till normaliseringen av erytrocytmembranens elasticitet, eftersom hypoxi och acidos avsevärt minskar erytrocyternas deformerbarhet. Ökad styvhet hos erytrocytmembranen vid chock är sannolikt förknippad med hämning av ATP-syntes i erytrocyter. I sin tur bidrar en minskning av ATP-koncentrationen till en ökning av Ca2+-koncentrationen i erytrocyter, vilket genom att binda till membranproteiner ökar membranets styvhet.
Ett av de farmakologiska läkemedlen som ökar ATP-halten i erytrocyter och elasticiteten hos erytrocytmembranen är Trental (pentoxifyllin), som används i klinisk praxis för att behandla ischemiska störningar.
Förutom att minska erytrocytmembranens styvhet orsakar Trental vasodilatation, förbättrar vävnadssyresättningen, hämmar fosfodiesterasaktiviteten i vävnader, ökar cAMP-koncentrationen och hämmar trombocytaggregation.
Bland andra farmakologiska medel som bibehåller erytrocytmembranets elasticitet är det värt att notera Ca2+-antagonister, som begränsar flödet av joner in i erytrocyterna (flunarizin, nifedipin, etc.).
 [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
[ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
Uppmärksamhet!
För att förenkla uppfattningen av information, är denna instruktion för användning av läkemedlet "Läkemedel som förhindrar trombos och förbättrar blodets reologi" översatt och presenterat i en speciell form på grundval av officiella instruktioner för medicinsk användning av läkemedlet. Före användning läs anteckningen som kom direkt till medicinen.
Beskrivning tillhandahålls för informationsändamål och är inte en guide till självläkning. Behovet av detta läkemedel, syftet med behandlingsregimen, metoder och dos av läkemedlet bestäms enbart av den behandlande läkaren. Självmedicinering är farlig för din hälsa.

