Medicinsk expert av artikeln
Nya publikationer
Vanemässigt missfall - Orsaker
Senast recenserade: 04.07.2025

Allt iLive-innehåll är mediekontrollerat eller faktiskt kontrollerat för att säkerställa så mycket faktuell noggrannhet som möjligt.
Vi har strikta sourcing riktlinjer och endast länk till välrenommerade media webbplatser, akademiska forskningsinstitut och, när det är möjligt, medicinsk peer granskad studier. Observera att siffrorna inom parentes ([1], [2] etc.) är klickbara länkar till dessa studier.
Om du anser att något av vårt innehåll är felaktigt, omodernt eller på annat sätt tveksamt, välj det och tryck på Ctrl + Enter.
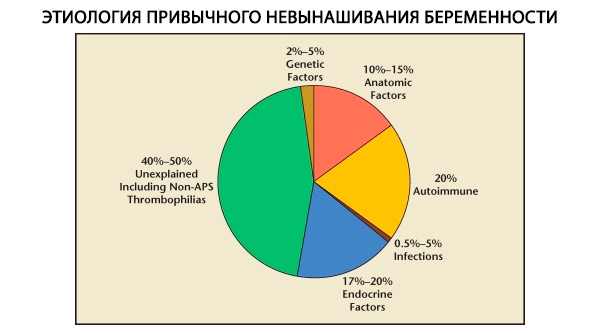
I strukturen av vanemässiga missfall urskiljs genetiska, anatomiska, endokrina, immunologiska och infektiösa faktorer. När alla ovanstående orsaker utesluts återstår en grupp patienter där ursprunget till vanemässiga missfall är oklart (idiopatiska missfall). Enligt C. Coulam et al. (1996) är 80 % av idiopatiska missfall baserade på okända immunstörningar.
Det finns inga övertygande bevis för att endometrios orsakar återkommande missfall, eller att medicinsk eller kirurgisk behandling av endometrios minskar förekomsten av återkommande missfall.
Enligt nuvarande koncept består implementeringen av den skadliga effekten av andra faktorer (anatomiska, endokrina, immunologiska), utöver genetiska och delvis infektiösa orsaker som leder till bildandet av ett onormalt embryo, i att skapa en ogynnsam bakgrund för utvecklingen av ett genetiskt komplett befruktat ägg, vilket leder till utarmning av chorions reservkapacitet och upphörande av utvecklingen (embryogenes). Kritiska perioder under graviditetens första trimester erkänns som 6-8 veckor (embryots död) och 10-12 veckor (utstötning av det befruktade ägget).
 [ 1 ]
[ 1 ]
Genetiska orsaker till vanemässigt missfall
Genetiska faktorer står för 3–6 % av orsakerna till haematiska missfall. Vid sporadiskt abort under första trimestern har cirka 50 % av aborterna kromosomavvikelser. De flesta av dem (95 %) är förändringar i antalet kromosomer - monosomi (förlust av en kromosom), trisomi (närvaro av en ytterligare kromosom), vilka är resultatet av fel i meiosen, samt polyploidi (en ökning av kromosomsammansättningen med en fullständig haploid uppsättning), vilket uppstår när ett ägg befruktas av två eller fler spermier. Vid sporadiska missfall förekommer trisomi oftast - 60 % av alla mutationer (oftast på kromosom 16, samt 13, 18, 21, 22), på andra plats i frekvens kommer Shereshevsky-Turners syndrom (kromosom 45 X0) - 20 %, de återstående 15 % beror på polyploidi (särskilt triploidi).
Vid en förändring av antalet kromosomer vid en abort avslöjar undersökningen av föräldrarnas karyotyp oftast ingen patologi och sannolikheten för en kromosomsjukdom hos fostret under en efterföljande graviditet är 1 %. Däremot observeras strukturella förändringar i kromosomerna (intra- och interkromosomala) i 3–6 % av fallen vid undersökning av aborter hos par med vanemässigt missfall. Vid undersökning av föräldrarnas karyotyp observeras balanserade kromosomala omstruktureringar i 7 % av fallen. Oftast handlar det om reciproka translokationer, där ett segment av en kromosom är beläget på platsen för ett annat segment av en icke-homolog kromosom, samt mosaik av könskromosomer, inversion och detektion av kromosomer i form av en ring. Vid förekomst av sådana omstruktureringar hos en av makarna hindras processerna för parning och separation av kromosomer under meiosen, vilket resulterar i förlust (deletion) eller fördubbling (duplikation) av kromosomsektioner i könscellerna. Detta resulterar i så kallade obalanserade kromosomala omstruktureringar, där embryot antingen är icke-livsdugligt eller fungerar som bärare av en allvarlig kromosomal patologi. Sannolikheten att få ett barn med obalanserade kromosomavvikelser vid förekomst av balanserade kromosomala omstruktureringar i karyotypen hos en av föräldrarna är 1–15 %. Skillnader i data är kopplade till omstruktureringarnas art, storleken på de involverade segmenten, bärarens kön och familjehistoria.
Diagnostik
Anamnes
- Ärftliga sjukdomar hos familjemedlemmar.
- Förekomst av medfödda missbildningar i familjen.
- Födelse av barn med utvecklingsstörning.
- Förekomst av infertilitet och/eller missfall av okänt ursprung hos ett gift par eller hos släktingar.
- Förekomst av oklara fall av perinatal dödlighet.
Speciella forskningsmetoder
- En studie av föräldrarnas karyotyp är särskilt indicerad för gifta par vid födseln av ett nyfött barn med utvecklingsdefekter utöver en historia av missfall, såväl som i fall av haemitmissfall i tidiga skeden av graviditeten.
- Cytogenetisk analys av abort vid dödfödsel eller neonatal dödlighet.
Indikationer för samråd med andra specialister
Om förändringar i karyotypen upptäcks hos föräldrarna är en konsultation med en genetiker nödvändig för att bedöma risken för att få ett barn med en patologi eller, om nödvändigt, för att besluta om att donera ett ägg eller spermier.
Vidare hantering av patienten
Om ett gift par har en patologisk karyotyp, även hos en av föräldrarna, rekommenderas det att utföra prenatal diagnostik under graviditeten - korionbiopsi eller fostervattensprov - på grund av den höga risken för utvecklingsstörningar hos fostret.
Anatomiska orsaker till vanemässigt missfall
Anatomiska orsaker till vanemässigt missfall inkluderar:
- medfödda missbildningar i livmoderns utveckling (fullständig fördubbling av livmodern; bihornad, sadelformad, enhörningsliknande livmoder; partiell eller fullständig intrauterin septum);
- förvärvade anatomiska defekter;
- intrauterina adherenser (Ashermans syndrom);
- submukösa livmoderfibroider;
- istmisk-cervikal insufficiens.
Frekvensen av anatomiska avvikelser hos patienter med haemitmissfall varierar från 10 till 16 %. Frekvensen av livmodermissbildningar som kan leda till missfall (men inte infertilitet) i förhållande till alla livmodermissbildningar är följande: bihornad livmoder - 37 %, sadelformad livmoder - 15 %, intrauterin septum - 22 %, fullständig fördubbling av livmodern - 11 %, enhörningsformad livmoder - 4,4 %.
Diagnos av vanemässigt missfall
Anamnes
Vid livmoderns anatomiska patologi observeras sena graviditetsavbrott och för tidiga födslar oftare, men vid implantation på det intrauterina septumet eller nära den myomatiska noden är tidiga graviditetsavbrott också möjliga.
Vid istmisk-cervikal insufficiens är det patognomoniska tecknet spontan abort under andra trimestern eller tidig förtidsfödsel, vilket sker relativt snabbt och med liten smärta.
Vid missbildningar i livmodern är det nödvändigt att vara uppmärksam på anamnestiska indikationer på urinvägarnas patologi (ofta åtföljande medfödda anomalier i livmodern) och arten av utvecklingen av menstruationsfunktionen (indikationer på hematometra med ett fungerande rudimentärt livmoderhorn).
Särskilda undersökningsmetoder
- För närvarande utförs hysterosalpingografi för att fastställa en diagnos, vilket gör det möjligt att studera livmoderhålans form, identifiera förekomsten av submukösa fibroider, adherenser, septa och bestämma äggledarnas öppenhet. För att diagnostisera livmoderpatologi är det rationellt att utföra hysterosalpingografi under perioden mellan menstruation och ägglossning, dvs. i den första fasen av menstruationscykeln efter att den blodiga flytningen upphört (7-9:e dagen i cykeln). För att diagnostisera istmisk-cervikal insufficiens utförs undersökningen i den andra fasen av menstruationscykeln (18-20:e dagen) för att bestämma tillståndet hos livmoderhalsens inre os. Innan hysterosalpingografi utförs är det nödvändigt att utesluta inflammatoriska sjukdomar i bäckenorganen eller behandla dem.
- Hysteroskopi har blivit utbrett under senare år och har blivit guldstandarden för att diagnostisera intrauterin patologi. På grund av dess högre kostnad jämfört med hysterosalpingografi används metoden dock hos kvinnor med indikation på intrauterin patologi baserat på preliminära ultraljudsdata. Hysteroskopi kan användas för att undersöka livmoderhålan, fastställa arten av den intrauterina patologin och, om nödvändig utrustning (resektoskop) finns tillgänglig, utföra minimalinvasiv kirurgisk behandling - avlägsnande av adherenser, submukösa myomnoder och endometriepolyper. Vid avlägsnande av en intrauterin septum föredras hysteroresektoskopi med laparoskopisk kontroll, vilket förhindrar risken för perforation av livmoderväggen.
- Ultraljud utförs i menstruationscykelns första fas, vilket möjliggör en presumtiv diagnos av submuköst livmodermyom, intrauterina adherenser, och i cykelns andra fas - för att identifiera en intrauterin septum och en bihornad livmoder. Denna metod är särskilt viktig i de tidiga stadierna av graviditeten, då dess känslighet för att diagnostisera dessa tillstånd är 100 % och dess specificitet är 80 %. Utanför graviditeten kräver diagnosen ytterligare bekräftelse med andra metoder.
- Utländska författare påpekar fördelen med sonohysterografi (ultraljud med en transvaginal sensor med preliminär introduktion av 0,9% natriumkloridlösning i livmoderhålan) jämfört med hysterosalpingografi, eftersom det möjliggör differentialdiagnostik mellan det intrauterina septumet och den bihornade livmodern. Med sonohysterografi är det inte bara möjligt att studera formen på livmoderhålan, utan också att bestämma konfigurationen av livmoderbotten. I vårt land har denna metod inte blivit utbredd.
- I vissa komplexa fall används MR av bäckenorganen för att verifiera diagnosen. Metoden möjliggör värdefull information vid utvecklingsanomalier i livmodern tillsammans med atypiska organ i bäckenet. MR är viktigt vid ett rudimentärt livmoderhorn för att avgöra om det är lämpligt att ta bort det. Behovet av att ta bort det rudimentära livmoderhornet uppstår om det är i kontakt med äggledaren och äggstocken för att förhindra bildandet och utvecklingen av det befruktade ägget i det. Avbrott vid anatomiska anomalier i livmodern kan vara förknippat med misslyckad implantation av det befruktade ägget (på den intrauterina septum, nära den submukösa myomnoden), otillräckligt utvecklad vaskularisering och mottagning av endometriet, nära rumsliga relationer i livmoderhålan (till exempel vid deformation av håligheten av en myomnod), ofta åtföljt av ICI, och hormonella störningar.
Behandling av vanemässigt missfall
Kirurgisk behandling
Vid förekomst av en intrauterin septum, submukösa myomnoder och adherenser är den mest effektiva kirurgiska behandlingen hysteroresektoskopi. Frekvensen av efterföljande missfall i denna grupp kvinnor efter behandling är 10 % jämfört med 90 % före operationen. Vid jämförelse av resultaten av metroplastik utförd med laparotomi och transcervikal hysteroresektoskopi erhöll P. Heinonen (1997) resultat som indikerade mindre trauma och större effektivitet av hysteroresektoskopi; andelen graviditeter som resulterade i livsdugliga barn var 68 respektive 86 %.
Kirurgiskt avlägsnande av intrauterin skiljevägg, sammanväxningar och submukösa myomnoder eliminerar missfall i 70–80 % av fallen. Det är dock ineffektivt hos kvinnor med livmodermissbildningar som har haft normala förlossningar med efterföljande återkommande missfall. Det är troligt att den anatomiska faktorn i sådana fall inte är den främsta orsaken, och det är nödvändigt att leta efter andra orsaker till missfall.
Det har bevisats att abdominell metroplastik är förknippad med en betydande risk för postoperativ infertilitet och inte förbättrar prognosen för efterföljande graviditeter. Därför är det bättre att prioritera hysteroskopi och laparoskopiska operationer.
Läkemedelsbehandling
Effektiviteten av införandet av spiral, höga doser av östrogena läkemedel, införandet av en Foley-kateter i livmoderhålan efter operationer för att avlägsna sammanväxningar, intrauterin septum har inte bevisats. Det rekommenderas att planera graviditet tidigast 3 månader efter operationen. För att förbättra endometriets tillväxt utförs cyklisk hormonbehandling under 3 menstruationscykler [14]. Under 3 månader under de första 14 dagarna av cykeln är det lämpligt att ta ett läkemedel som innehåller 2 mg 17-beta-östradiol, under de kommande 14 dagarna - 2 mg 17-beta-östradiol och 20 mg dydrogesteron (10 mg dydrogesteron som en del av ett kombinationsläkemedel plus 10 mg dydrogesteron i en separat tablettform).
Vidare hantering av patienten
Funktioner i graviditetsförloppet med en bicornuate livmoder eller fördubbling av livmodern (när det finns 2 livmoderhålor):
- i de tidiga stadierna av graviditeten uppstår ofta blödning från det "tomma" hornet eller livmoderhålan på grund av en uttalad decidualreaktion; taktiken i detta fall bör vara konservativ och bestå av användning av antispasmodiska och hemostatiska medel;
- hot om graviditetsavbrott i olika skeden;
- utveckling av istmisk-cervikal insufficiens;
- intrauterin tillväxthämning på grund av placentainsufficiens.
I de tidiga stadierna av graviditeten, vid blödning, rekommenderas sängläge och halvsängläge, liksom administrering av hemostatiska, kramplösande och lugnande läkemedel, och behandling med gestagener (dydrogesteron i en daglig dos på 20 till 40 mg) upp till 16–18 graviditetsveckor.
Endokrina orsaker till vanemässigt missfall
Enligt olika författare står endokrina orsaker till missfall för 8 till 20 %. De viktigaste av dessa är lutealfasbrist (LPD), hypersekretion av LH, sköldkörteldysfunktion och diabetes mellitus.
Allvarlig sköldkörtelsjukdom eller diabetes mellitus kan leda till upprepade missfall. Vid kompenserad diabetes mellitus skiljer sig dock inte risken för habituella missfall från den i den allmänna befolkningen.
Samtidigt kräver den höga incidensen av hypotyreos i befolkningen screening med mätning av TSH-nivåer. Hos patienter med habituellt missfall observeras lutealfasinsufficiens i 20–60 % av fallen, och ultraljudstecken på polycystiska äggstockar - i 44–56 %. Enligt litteraturen är inverkan av individuella hormonella störningar på bildandet av symtomkomplexet vid habituellt missfall fortfarande kontroversiell. Studierna av M. Ogasawara et al. (1997) visade inte tillförlitliga skillnader i frekvensen av graviditetsavbrott med och utan LPI hos patienter med två eller fler tidigare missfall i anamnesen, exklusive autoimmuna, anatomiska och infektiösa orsaker.
Brist på corpus luteumfunktionen kan bero på ett antal ogynnsamma faktorer:
- störningar i utsöndringen av FSH och LH i den första fasen av menstruationscykeln;
- tidig eller, omvänt, för sen topp av LH-frisättning;
- hypoöstrogenism som en följd av otillräcklig follikulogenes. Alla dessa tillstånd kan inte korrigeras genom ersättningsterapi med gestagenläkemedel under den postovulatoriska perioden. Prospektiva studier utförda av L. Regan et al. visade en signifikant ökning av missfallsfrekvensen hos patienter med LH-hypersekretion på den 8:e dagen i menstruationscykeln jämfört med kvinnor med normala LH-nivåer i blodet (65 % respektive 12 % av missfallen). Den skadliga effekten av en för tidig LH-ökning är förknippad med för tidig återupptagning av den andra meiotiska delningen och ägglossning av ett omoget ägg, samt med induktion av androgenproduktion av thecaceller tillsammans med nedsatt endometriemottagning under inverkan av gestageninsufficiens. Emellertid ger en preliminär minskning av preovulatoriska LH-nivåer med gonadotropinfrisättande hormonagonister utan ytterligare åtgärder som syftar till att förlänga efterföljande graviditet inte den förväntade minskningen av missfallsfrekvensen.
Guldstandarden för att diagnostisera NLF är histologisk undersökning av material erhållet från endometriebiopsi i cykelns andra fas under 2 menstruationscykler.
Diagnos av andra orsaker till ägglossningsdysfunktion, såsom hyperprolaktinemi, hypotyreos, funktionellt överskott av androgener (äggstockar eller binjurar), måste åtföljas av förskrivning av lämplig behandling.
Diagnostik
Anamnes och fysisk undersökning
- Anamnes. Faktorer att beakta: sen menark, oregelbunden menstruationscykel (oligomenorré, amenorré, plötslig viktökning, viktminskning, infertilitet, återkommande tidiga missfall).
- Undersökning: kroppstyp, längd, kroppsvikt, hirsutism, svårighetsgraden av sekundära sexuella egenskaper, förekomst av striae, undersökning av mjölkkörtlar för galaktorré.
- Funktionella diagnostiska tester: mätning av rektaltemperatur under 3 menstruationscykler.
Speciella forskningsmetoder
- Hormonell studie:
- i den första fasen av menstruationscykeln (7–8:e dagen) – bestämning av innehållet av FSH, LH, prolaktin, TSH, testosteron, 17-hydroxiprogesteron (17-OP), DHEAS;
- i den andra fasen av menstruationscykeln (21–22 dagar) – bestämning av progesteronhalten (normativa indikatorer för progesteronnivåer är mycket varierande, metoden kan inte användas utan att ta hänsyn till andra faktorer).
- Ultraljud:
- i den första fasen av menstruationscykeln (5–7:e dagen) – diagnos av endometriepatologi, polycystiska äggstockar;
- i menstruationscykelns andra fas (20–21 dagar) – mätning av endometriets tjocklek (normalt 10–11 mm, korrelerar med progesteronhalten).
- En endometriebiopsi för att verifiera endometriumlemhinnan (NLF) utförs 2 dagar före förväntad menstruation (på den 26:e dagen vid en 28-dagarscykel). Denna metod används i fall där diagnosen är oklar. För att studera förändringar i endometriet under den så kallade "implantationsfönstret"-perioden utförs en biopsi på den 6:e dagen efter ägglossning.
Behandling
Vid diagnos av NLF (enligt rektala temperaturdiagram är den andra fasens varaktighet mindre än 11 dagar, en stegvis temperaturökning observeras, otillräcklig sekretorisk transformation av endometriet enligt endometriebiopsidata, låga nivåer av progesteron i blodserumet) är det nödvändigt att identifiera orsaken till sådana störningar.
Om NLF åtföljs av hyperprolaktinemi utförs MR av hjärnan. En alternativ metod är röntgen av skallen (sella turcica-regionen).
Det första steget vid hyperprolaktinemi är att utesluta hypofysadenom, vilket kräver kirurgisk behandling. I avsaknad av signifikanta förändringar anses hyperprolaktinemi vara funktionell, och bromokriptinbehandling ordineras för att normalisera prolaktinnivåerna. Den initiala dosen bromokriptin är 1,25 mg/dag i 2 veckor, efter övervakning av prolaktinnivåerna, om indikatorerna inte normaliseras, ökas dosen till 2,5 mg/dag. Vid en signifikant ökning av prolaktinnivåerna är den initiala dosen 2,5 mg/dag. Om graviditet uppstår bör bromokriptin sättas ut.
Om hypotyreos upptäcks, fastställs sköldkörtelpatologins natur tillsammans med en endokrinolog. I vilket fall som helst är daglig natriumlevotyroxinbehandling indicerad, dosen väljs individuellt tills TSH-nivån är normaliserad. Om graviditet inträffar bör behandlingen med natriumlevotyroxin fortsätta. Frågan om lämpligheten av att öka dosen under graviditetens första trimester avgörs tillsammans med en endokrinolog efter att ha fått resultaten av en hormonundersökning (TSH-nivå, fritt tyroxin).
Korrigering av NLF utförs på ett av två sätt. Det första sättet är ägglossningsstimulering, det andra sättet är ersättningsterapi med progesteronpreparat.
Det första behandlingsalternativet är ägglossningsstimulering med klomifencitrat. Denna behandlingsmetod bygger på det faktum att de flesta lutealfasrubbningar uppstår i cykelns follikulära fas. Ständigt minskade progesteronnivåer i den andra fasen är en konsekvens av nedsatt follikulogenes i cykelns första fas. Denna rubbning korrigeras med större framgång genom låga doser klomifencitrat i den tidiga follikulära fasen än genom att förskriva progesteron i cykelns andra fas.
Under den första cykeln är dosen klomifencitrat 50 mg/dag från den 5:e till den 9:e dagen i menstruationscykeln. Effektiviteten övervakas med hjälp av rektala temperaturmätningar, progesteronnivåmätningar under cykelns andra fas eller dynamisk ultraljud. Om tillräcklig effekt inte uppnås under den andra cykeln av ägglossningsstimulering, bör dosen klomifencitrat ökas till 100 mg/dag från den 5:e till den 9:e dagen i cykeln. Maximal möjlig dos under den tredje cykeln av ägglossningsstimulering är 150 mg/dag. En sådan dosökning är endast möjlig om läkemedlet tolereras väl (ingen intensiv smärta i nedre delen av buken och nedre delen av ryggen och inga andra tecken på ovariell hyperstimulering).
Det andra behandlingsalternativet: ersättningsterapi med progesteronpreparat, som främjar fullständig sekretorisk transformation av endometriet, vilket ger den nödvändiga effekten hos patienter med haetoniskt missfall med bibehållen ägglossning. Dessutom har det under senare år fastställts att administrering av progesteronpreparat inte bara har en hormonell utan även en immunmodulerande effekt, vilket undertrycker avstötningsreaktioner från immunkompetenta celler i endometriet. I synnerhet har en liknande effekt beskrivits för dihydrogesteron i en dos av 20 mg/dag. För ersättningsterapi används dydrogesteron i en dos av 20 mg/dag oralt eller mikroniserat progesteron vaginalt i en dos av 200 mg/dag. Behandlingen utförs den andra dagen efter ägglossning (dagen efter ökningen av rektaltemperaturen) och fortsätter i 10 dagar. Om graviditet inträffar bör behandlingen med progesteronpreparat fortsätta.
Modern forskning har inte bekräftat effektiviteten av humant koriongonadotropin vid behandling av återkommande missfall.
Vid hyperandrogenism (äggstocks- eller binjuregenes) hos patienter med habituellt missfall är läkemedelsbehandling indicerad på grund av androgeners effekt på ägglossningens fullständighet och endometriets tillstånd. Vid en störning av biosyntesen av binjureandrogener är deras viriliserande effekt på det kvinnliga fostret möjlig, därför utförs steroidbehandling i fostrets intresse.
Hyperandrogenism av äggstocksgenes (polycystiska äggstockar)
Anamnes, fysisk undersökning och resultat från specialundersökning
- Anamnes: sen menark, menstruationsrubbningar såsom oligomenorré (vanligtvis primär, mer sällan sekundär). Graviditeter är sällsynta, vanligtvis spontant avbrutna under första trimestern, med långa perioder av infertilitet mellan graviditeterna.
- Undersökning: hirsutism, akne, bristningar, högt BMI (valfritt).
- Rektala temperaturdiagram: anovulatoriska cykler växlar med cykler med ägglossning och icke-leverans av ägglossning.
- Hormonundersökning: höga testosteronnivåer, FSH- och LH-nivåerna kan vara förhöjda, LH/FSH-kvoten är större än 3. Ultraljud: polycystiska äggstockar.
Behandling
Icke-läkemedelsbehandling
Viktminskning - dietbehandling, fysisk aktivitet.
Läkemedelsbehandling
- Orlistat i en dos på 120 mg till varje huvudmåltid. Behandlingstiden bestäms med hänsyn till effekt och tolerans.
- Preliminär testosteronsänkning med preparat innehållande cyproteronacetat (2 mg) och EE (35 mcg) under 3 menstruationscykler.
- Utsättning av preventivmedel, hormonellt stöd under cykelns andra fas (gestagenbehandling) - dydrogesteron i en dos av 20 mg/dag från den 16:e till den 25:e dagen i menstruationscykeln. Om ingen spontan ägglossning sker, fortsätt till nästa steg.
- Stimulering av ägglossning med klomifencitrat i en initial dos på 50 mg/dag från menstruationscykelns 5:e till 9:e dag med samtidig behandling med gestagener (dydrogesteron i en dos på 20 mg/dag från cykelns 16:e till 25:e dag) och dexametason (0,5 mg).
- Vid avsaknad av graviditet ökas dosen klomifencitrat till 100–150 mg/dag med administrering av gestagener i cykelns andra fas och dexametason (0,5 mg). Det har fastställts att även om dexametason endast minskar nivån av binjureandrogener, sker ägglossning och befruktning betydligt oftare vid behandling med klomifencitrat och dexametason än vid användning av enbart klomifencitrat [12].
- Tre cykler av ägglossningsstimulering utförs, varefter ett uppehåll av tre menstruationscykler med gestagent stöd och beslut om kirurgisk behandling med laparoskopisk åtkomst (kilresektion av äggstockarna, laservaporisering) rekommenderas.
Vidare hantering av patienten
Graviditetshantering bör åtföljas av gestagent stöd upp till graviditetsvecka 16 (dydrogesteron i en dos på 20 mg/dag eller mikroniserat progesteron i en dos på 200 mg/dag). Dexametason förskrivs endast under graviditetens första trimester. Övervakning är obligatorisk för snabb diagnos av istmisk-cervikal insufficiens och, om nödvändigt, kirurgisk korrigering.
Adrenal hyperandrogenism (pubertalt och postpubertalt adrenogenitalt syndrom)
Adrenogenitalt syndrom (AGS) är en ärftlig sjukdom som är förknippad med en störning i syntesen av hormoner i binjurebarken på grund av skador på gener som ansvarar för syntesen av ett antal enzymsystem. Sjukdomen ärvs autosomalt recessivt med överföring av muterade gener från båda föräldrarna, som är friska bärare.
I 90 % av fallen orsakas adrenogenitalt syndrom av mutationer i CYP21B-genen, vilket leder till en störning i syntesen av 21-hydroxylas.
Anamnes, fysisk undersökning och resultat från specialundersökning
- Anamnes: sen menark, något förlängd menstruationscykel, möjlig oligomenorré, spontanaborter under första trimestern, möjlig infertilitet.
- Undersökning: akne, hirsutism, android kroppstyp (breda axlar, smalt bäcken), klitorishypertrofi.
- Rektala temperaturdiagram: anovulatoriska cykler växlar med cykler med ägglossning och icke-leverans av ägglossning.
- Hormontest: höga nivåer av 17-OP, DHEAS.
- Ultraljud: äggstockarna är oförändrade.
Ett patognomoniskt tecken utanför graviditeten är en ökning av koncentrationen av 17-OP i blodplasman.
För närvarande används ett test med ACTH för att diagnostisera den latenta, icke-klassiska formen av adrenal hyperandrogenism. För detta test används Synacthen - en syntetisk polypeptid som har egenskaperna hos endogen ACTH, dvs. den stimulerar de initiala faserna av syntesen av steroidhormoner från kolesterol i binjurarna.
Synacthen-test (en ACTH-analog): 1 ml (0,5 mg) synacthen injiceras subkutant i axeln, initialhalten av 17-OP och kortisol bestäms först i morgonens 9-timmars blodplasmaprov. Ett kontrollblodprov tas 9 timmar efter injektionen för att bestämma nivån av 17-OP och kortisol. Bestämningsindex (D) beräknas sedan med hjälp av formeln:
D = 0,052 × 17-OP + 0,005 × Kortisol/17-OP - 0,018 × Kortisol/17-OP
Om D-koefficienten är mindre än eller lika med 0,069 indikerar detta avsaknad av binjurehyperandrogenism. Om D-koefficienten är högre än 0,069 bör man beakta att hyperandrogenism orsakas av en dysfunktion i binjurarna.
Läkemedelsbehandling
Huvudbehandlingen för hyperandrogenism på grund av 21-hydroxylasbrist är glukokortikoider, som används för att undertrycka överskott av androgensekretion.
Vidare hantering av patienten
På grund av den viriliserande effekten av moderns androgener på fostret, vid en fastställd diagnos av adrenal hyperandrogenism, ordineras behandling med dexametason med en initial dos på 0,25 mg före graviditeten och fortsätter med en individuellt vald dos (från 0,5 till 1 mg) under hela graviditeten. Hos en kvinna med vanemässigt missfall som lider av adrenal hyperandrogenism är det olämpligt att avbryta behandlingen, eftersom frekvensen av missfall i frånvaro av behandling når 14 %, med fortsättning - 9 %.
Med tanke på att patienter med adrenogenitalt syndrom kan överföra denna gen till fostret är det nödvändigt att utföra prenatal diagnostik: vid 17-18 veckors graviditet ordineras ett blodprov för att bestämma innehållet av 17-OP hos modern. Om hormonnivån i blodet ökar bestäms dess koncentration i fostervattnet. Om innehållet av 17-OP i fostervattnet ökar diagnostiseras adrenogenitalt syndrom hos fostret. Tyvärr är det omöjligt att fastställa svårighetsgraden av adrenogenitalt syndrom (mild eller saltförbrukande svår form) utifrån nivån av 17-OP i fostervattnet. Frågan om att upprätthålla graviditeten i denna situation avgörs av föräldrarna.
Om barnets far är bärare av genen för adrenogenitalt syndrom och det har förekommit fall av barn i familjen med detta syndrom, får patienten, även utan adrenal hyperandrogenism, dexametason i fostrets intresse (för att förhindra virilisering av det kvinnliga fostret) i en dos av 20 mcg/kg kroppsvikt, maximalt 1,5 mg/dag i 2-3 doser efter måltider. Vid 17-18 veckor, efter att fostrets kön och uttrycket av genen för adrenogenitalt syndrom har bestämts (baserat på resultaten av fostervattensprov), fortsätter behandlingen till slutet av graviditeten om fostret är en flicka med adrenogenitalt syndrom. Om fostret är en pojke eller en flicka som inte är bärare av genen för adrenogenitalt syndrom, kan dexametason sättas ut.
Om en kvinna med vanemässigt missfall lider av binjurehyperandrogenism, utförs dexametasonbehandling under hela graviditeten och avbryts först efter förlossningen. På den tredje dagen efter förlossningen minskas dexametasondosen gradvis (med 0,125 mg var tredje dag) tills behandlingen avslutas helt efter förlossningen.
Hyperandrogenism av blandad genes (äggstockar och binjurar)
Anamnes, fysisk undersökning och resultat från specialundersökning
- Anamnes: sen menark, menstruationsrubbningar såsom oligomenorré (vanligtvis primär, mer sällan sekundär), amenorré, eventuella skador, hjärnskakning. Graviditeter är sällsynta, vanligtvis spontant avbrutna under första trimestern, långa perioder av infertilitet mellan graviditeterna.
- Fysisk undersökning: hirsutism, akne, striae, acanthosis nigricans, högt BMI, hypertoni.
- Rektala temperaturdiagram: anovulatoriska cykler växlar med cykler med ägglossning och icke-leverans av ägglossning.
- Hormonundersökning: höga testosteronnivåer, FSH- och LH-nivåerna kan vara förhöjda, LH/FSH-förhållande större än 3, höga DHEAS- och 17-OP-nivåer, hyperprolaktinemi kan förekomma.
- Ultraljud: polycystiska äggstockar.
- Elektroencefalografi: förändringar i hjärnans bioelektriska aktivitet.
- Hyperinsulinemi, lipidmetabolismrubbning (högt kolesterol, lågdensitetslipoproteiner och mycket lågdensitetslipoproteiner), minskad glukostolerans eller förhöjda blodsockernivåer.
Behandling
Icke-läkemedelsbehandling
Viktminskning (kalorifattig kost, fysisk aktivitet).
Läkemedelsbehandling
Det första steget - i närvaro av insulinresistens rekommenderas att man förskriver metformin i en daglig dos på 1000-1500 mg för att öka insulinkänsligheten.
Det andra steget - vid allvarliga menstruationscykelrubbningar och höga testosteronnivåer rekommenderas att förskriva läkemedel med antiandrogen effekt innehållande cyproteronacetat (2 mg) och etinylestradiol (35 mcg) i 3 månader.
Det tredje steget är stimulering av ägglossning följt av gestagent stöd (schemat beskrivs ovan) och intag av dexametason i en daglig dos på 0,25–0,5 mg.
Vid hyperprolaktinemi och hypotyreos bör lämplig läkemedelskorrigering utföras under ägglossningsstimuleringscykler. Om graviditet inträffar bör bromokriptin sättas ut och levotyroxin fortsättas.
Om ägglossningsstimulering är ineffektiv bör frågan om att förskriva direkta ägglossningsinducerare, lämpligheten av kirurgisk behandling av polycystiska äggstockar eller in vitro-fertilisering avgöras.
Vidare hantering av patienten
Hos patienter med metabolt syndrom kompliceras graviditeten ofta av arteriell hypertoni, nefropati och hyperkoagulation, vilket gör att det är nödvändigt att övervaka blodtrycket och ta hemostasiogram från tidiga graviditetsstadier och korrigera uppkomna störningar (vid behov) med blodtryckssänkande läkemedel, trombocythämmande medel och antikoagulantia. Gestageniska läkemedel förskrivs upp till 16 veckors graviditet - didrogesteron i en dos av 20 mg/dag eller mikroniserat progesteron i en dos av 200 mg/dag i 2 doser.
Alla kvinnor med hyperandrogenism representerar en riskgrupp för utveckling av istmisk-cervikal insufficiens. Övervakning av livmoderhalsens tillstånd bör utföras från och med den 16:e graviditetsveckan, vid behov - kirurgisk korrigering av istmisk-cervikal insufficiens.
Immunologiska orsaker till vanemässigt missfall
Det är för närvarande känt att cirka 80 % av alla tidigare oförklarade fall av upprepad missfall (efter att genetiska, anatomiska och hormonella orsaker uteslutits) är förknippade med immunförsvarsstörningar. Autoimmuna och alloimmuna sjukdomar särskiljs, vilket leder till haemitmissfall.
Vid autoimmuna processer blir immunförsvarets egna vävnader föremål för aggression, det vill säga immunsvaret riktas mot dess egna antigener. I denna situation lider fostret sekundärt till följd av skador på moderns vävnader.
Vid alloimmuna sjukdomar riktas en kvinnas immunsvar mot embryonala/fosterantigener som mottagits från fadern och som potentiellt är främmande för moderns kropp.
Autoimmuna sjukdomar som oftast förekommer hos patienter med habituellt missfall inkluderar förekomsten av antifosfolipid-, antityreoid- och antinukleära autoantikroppar i serum. Det har således fastställts att 31 % av kvinnor med habituellt missfall utanför graviditeten har autoantikroppar mot tyreoglobulin och tyreoideaperoxidas (tyreoideamikrosomala [tyreoideaperoxidas] autoantikroppar); i dessa fall ökar risken för spontant missfall under graviditetens första trimester till 20 %. Vid habituellt missfall indikerar förekomsten av antinukleära och antityreoida antikroppar behovet av ytterligare undersökning för att identifiera den autoimmuna processen och verifiera diagnosen.
Antifosfolipidsyndrom (APS) är fortfarande ett allmänt erkänt autoimmunt tillstånd som leder till embryo-/fosterdöd.
Alloimmuna sjukdomar
För närvarande inkluderar alloimmuna processer som leder till fosteravstötning närvaron av ett ökat (mer än 3) antal gemensamma antigener från det stora histokompatibilitetskomplexet hos makar (observeras ofta i blodsäktenskap); låga nivåer av blockerande faktorer i moderns serum; ökade nivåer av naturliga mördarceller (NK-celler CD56, CD16) i endometriet och perifert blod hos modern både utanför och under graviditeten; höga koncentrationsnivåer av ett antal cytokiner i endometriet och blodserum, i synnerhet γ-interferon, tumörnekrosfaktor a, interleukiner-1 och 2.
För närvarande studeras alloimmuna faktorer som leder till tidiga graviditetsförluster och sätt att korrigera ovanstående tillstånd. Det finns ingen konsensus om behandlingsmetoderna. Enligt vissa forskare ger aktiv immunisering med donatorlymfocyter inte någon signifikant effekt, medan andra författare beskriver en signifikant positiv effekt med sådan immunisering och behandling med immunglobuliner.
För närvarande är progesteron ett av de immunmodulerande medlen i tidig graviditet. I synnerhet har studier bevisat dydrogesterons roll i en daglig dos på 20 mg hos kvinnor med vanemässiga missfall under graviditetens första trimester med en ökad nivå av CD56-celler i endometriet.
 [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
Genetiskt betingade trombofilier
Följande former av genetiskt betingade trombofilier anses vara trombofila tillstånd under graviditet som leder till haematiskt missfall.
- Antitrombin III-brist.
- Faktor V-mutation (Leiden-mutation).
- Protein C-brist.
- Protein S-brist.
- Protrombin-genmutation G20210A.
- Hyperhomocysteinemi.
Undersökning för att identifiera sällsynta orsaker till trombofili är nödvändig i fall där det fanns:
- familjehistoria - tromboembolism före 40 års ålder hos släktingar;
- tillförlitliga episoder av venös och/eller arteriell trombos före 40 års ålder;
- återkommande trombos hos patienten och närmaste anhöriga;
- tromboemboliska komplikationer under graviditet och efter förlossning vid användning av hormonellt preventivmedel;
- upprepade missfall, dödfödslar, intrauterin tillväxthämning, moderkaksavlossning;
- tidig preeklampsi, HELLP-syndrom.
Infektiösa orsaker till vanemässigt missfall
Infektionsfaktorns roll som orsak till vanemässiga missfall är för närvarande föremål för omfattande debatt. Det är känt att primärinfektion i tidiga stadier av graviditeten kan orsaka skador på embryot som är oförenliga med liv, vilket leder till sporadiska spontana missfall. Sannolikheten för reaktivering av infektionen samtidigt med upprepade missfall är dock försumbar. Dessutom har mikroorganismer som framkallar vanemässiga missfall inte hittats för närvarande. Studier under senare år har visat att de flesta kvinnor med vanemässiga missfall och kronisk endometrit har en prevalens av 2-3 eller fler typer av obligata anaeroba mikroorganismer och virus i endometriet.
Enligt VM Sidelnikova et al. verifierades diagnosen kronisk endometrit utanför graviditeten histologiskt hos kvinnor som lider av habeteliga missfall i 73,1 % av fallen och i 86,7 % observerades persistens av opportunistiska mikroorganismer i endometriet, vilket säkerligen kan vara orsaken till aktivering av immunopatologiska processer. Blandad persistent virusinfektion (herpes simplex-virus, Coxsackie A, Coxsackie B, enterovirus 68–71, cytomegalovirus) förekommer hos patienter med habeteliga missfall betydligt oftare än hos kvinnor med normal obstetrisk historia. K. Kohut et al. (1997) visade att andelen inflammatoriska förändringar i endometriet och decidualvävnaden hos patienter med primärt återkommande missfall är signifikant högre än hos kvinnor efter missfall med en historia av minst en fullgången förlossning.
Bakteriell och viral kolonisering av endometriet beror vanligtvis på immunsystemets och kroppens ospecifika skyddskrafter (komplementsystemet, fagocytos) oförmåga att helt eliminera smittämnet, och samtidigt begränsas dess spridning av aktiveringen av T-lymfocyter (T-hjälpare, naturliga mördare) och makrofager. I alla ovanstående fall uppstår persistens av mikroorganismer, vilket kännetecknas av att mononukleära fagocyter, naturliga mördare, T-hjälpare, som syntetiserar olika cytokiner, attraheras till platsen för kronisk inflammation. Tydligen förhindrar ett sådant tillstånd hos endometriet skapandet av lokal immunsuppression under preimplantationsperioden, vilket är nödvändigt för att bilda en skyddande barriär och förhindra avstötning av ett halvfrämmande foster.
I detta avseende bör kvinnor med vanemässigt missfall diagnostiseras med kronisk endometrit före graviditet. För att fastställa eller utesluta denna diagnos utförs en endometriebiopsi på 7:e-8:e dagen i menstruationscykeln med histologisk undersökning, PCR och bakteriologisk undersökning av materialet från livmoderhålan. Vid verifiering av diagnosen behandlas kronisk endometrit enligt standarderna för behandling av inflammatoriska sjukdomar i bäckenorganen.

