Medicinsk expert av artikeln
Nya publikationer
Diagnos av stadier av prostatacancer kurs
Senast recenserade: 04.07.2025

Allt iLive-innehåll är mediekontrollerat eller faktiskt kontrollerat för att säkerställa så mycket faktuell noggrannhet som möjligt.
Vi har strikta sourcing riktlinjer och endast länk till välrenommerade media webbplatser, akademiska forskningsinstitut och, när det är möjligt, medicinsk peer granskad studier. Observera att siffrorna inom parentes ([1], [2] etc.) är klickbara länkar till dessa studier.
Om du anser att något av vårt innehåll är felaktigt, omodernt eller på annat sätt tveksamt, välj det och tryck på Ctrl + Enter.
Kliniskt skiljer man mellan lokaliserad (T1-2 , N0 , M0 ), lokalt avancerad (T3-4 , N0-1 , M0 ) och generaliserad cancer (T1-4 , N0-1 , M1 ).
Patienter med kliniskt lokaliserade och lokalt avancerade stadier klassificeras efter riskgrad (D'Amico A V. et al., 2003):
- lågt: stadium T 1a-c; PSA-nivå lägre än 10 ig/ml: Gleason-gradering - 2-5; i biopsi - unilateral lesion mindre än 50%:
- måttlig: stadium T 2a; PSA-nivå lägre än 10 ng/ml; Gleason-poäng - 3 + 4 = 7; i biopsi - bilateral lesion mindre än 50 %;
- högt stadium T2b , T3a -b; PSA-nivå - 10–20 ng/ml; Gleason-gradering - mer än 4 + 3–7; i biopsi - skada mer än 50 %, perineural invasion;
- mycket högt: stadium T4 ; PSA-nivå över 20 ng/ml; Gleason-poäng över 8; biopsi visar lymfatisk invasion.
Efter att diagnosen har klarlagts och processens omfattning har fastställts (lokaliserad, lokalt avancerad eller generaliserad) står läkaren och patienten inför ett val av behandlingsmetod. I det moderna samhället läggs stor vikt vid patienternas livskvalitet efter behandlingsstart. Livskvaliteten utan behandling motsvarar förloppet av den underliggande sjukdomen och beror på hur den onkologiska processen fortskrider. Förändringar i livskvaliteten sker huvudsakligen efter behandlingsstart och användning av en av de terapeutiska eller kirurgiska metoderna. Att tydligt fastställa processens stadium gör det inte bara möjligt att välja den optimala behandlingsmetoden, utan också att förutsäga sjukdomens fortsatta förlopp.
Bestämning av PSA-nivån i kombination med den kliniska bilden av prostatacancer och tumörens gradering enligt Gleason-skalan ökar avsevärt informationsinnehållet i var och en av de listade indikatorerna för att fastställa cancerns patologiska stadium. AV Partin et al. (1997) föreslog prognostiska tabeller som gör det möjligt att förutsäga tumörens vidare spridning, val av behandlingsmetod, graden av radikalitet och prognosen för behandlingens effektivitet.
För att bedöma tumörens spridning är de vanligaste metoderna DRE, TRUS, bestämning av PSA-nivå och skelettscintigrafi. Vid behov förskrivs datortomografi (CT) eller magnetisk resonanstomografi (MRT) och lungröntgen.
Alla avbildningsmetoder är utformade för att bestämma stadium och bedöma behandlingens effektivitet. Efter att ha verifierat diagnosen måste urologen klargöra den primära tumörens volym, dess gränser, tumörens invasiva eller metastatiska potential. Alla dessa indikatorer är av stor betydelse för sjukdomens prognos och valet av behandlingsmetod.
Primärtumör (T)
Först och främst är det nödvändigt att avgöra om tumören är begränsad till prostatakörteln (T1-2 ) eller sträcker sig bortom kapseln (T3-4 ). Digital undersökning tillåter ofta inte att bedöma tumörens spridning. Enligt vissa data motsvarar resultaten av DRE de från histologisk undersökning hos mindre än 50% av patienterna. En mer detaljerad undersökning är dock endast indicerad när man beslutar om radikal behandling.
PSA-nivån kan återspegla tumörens utbredning, men möjliggör inte en korrekt bestämning av det morfologiska stadiet. Kombinationen av PSA-nivå, Gleasonindex och palpationsdata möjliggör en bättre förutsägelse av det morfologiska stadiet än var och en av dessa parametrar separat. Värdet av fritt PSA är kontroversiellt: i en studie hjälpte bestämning av halten fritt PSA till att klargöra stadiet i lokaliserade tumörer, men andra studier bekräftade inte detta. Endast djupgående studier kommer att bidra till att lösa denna fråga.
Transrektal ultraljud används oftast för att undersöka prostatakörtelns tillstånd. Denna metod kan endast upptäcka 60 % av tumörerna och visar inte alltid kapselinvasion. Nästan 60 % av patienterna har stadium T3 . Ultraljud indikerar en mindre vanlig process. Ultraljudstecken på kapselinvasion är utbuktning, ojämnheter och bristning av körtelkonturen. Invasion av tumörceller i sädesblåsorna är ett dåligt prognostiskt tecken, men information om det är oerhört viktigt för att välja en behandlingsmetod. Vid utförande av TRUS bör uppmärksamhet ägnas åt vesiklarnas ekostruktur (hyperekogenicitet), deras asymmetri, deformation och expansion. Skador på sädesblåsorna indikeras också av förlust av rundhet och kompaktering vid körtelns bas. Dessa tecken är ganska subjektiva, så det är olämpligt att helt förlita sig på ultraljudsdata. Invasion av sädesblåsorna indikerar en hög risk för lokalt återfall och metastaser, och deras biopsi är indicerad för klargörande (före operation). Undersökningen bör inte påbörjas med denna procedur, men om risken för invasion är hög och valet av behandling beror på biopsiresultatet, är dess genomförande motiverat. Ett negativt resultat utesluter inte mikroskopisk invasion. Som regel utförs en biopsi av sädesblåsorna i det kliniska stadiet T2b och högre och PSA-halten är mer än 10 ng/ml. Resultatet anses positivt om minst en biopsi från prostatakörteln innehåller tumörceller. Inte bara ytterligare studier, utan också en grundlig analys av resultaten från den primära biopsin gör det möjligt att öka noggrannheten i den kliniska bestämningen av stadiet (antalet och omfattningen av tumörfokus, kapselinvasion spelar en roll). Graden av differentiering är också viktig: med ett Gleason-index på mindre än 6 är tumören lokaliserad i 70% av fallen.
Blodflödet i prostatakörteln vid cancer är högre än i en normal körtel eller vid hyperplasi. Efter kastrering minskar blodflödets intensitet i körteln. Utvecklingen av ekodopplerografiska kartor för diagnos och övervakning av prostatacancer är lovande, men för närvarande finns det inga tillförlitliga data om användningen av ekodopplerografi för att bestämma stadiet av den lokala processen. Det är möjligt att använda denna metod för att erhålla ytterligare material under riktad biopsi från fokus för patologisk vaskularisering.
Resultaten av visualisering av prostatacancer är direkt beroende av klinikens tekniska utrustning och specialistens erfarenhet. Det är därför alla moderna visualiseringsmetoder inte spelar en avgörande utan en klargörande roll, och valet av behandlingsmetod baseras på en kombination av kliniska undersökningsdata och instrumentella studier.
MR har de bästa möjligheterna att visualisera prostatakörtelns struktur. Den moderna standarden för att undersöka bäckenorganen med hjälp av MR-metoden är användningen av en endorektal sensor, vilket möjliggör en bild med högsta möjliga rumsliga upplösning på 0,5-1 mm. Att tvinga in luft i den endorektala sensorn ger en tydlig visualisering av prostatakapseln, rektoprostatiska vinklar och Denonvilliers rektoprostatiska fascia. Användningen av en endorektal sensor vid MR begränsar inte visualiseringen av regionala lymfkörtlar (upp till nivån för bifurkationen av bukaorta). Prostatacancer kännetecknas av låg signalintensitet på T-viktade bilder mot bakgrund av en högintensiv signal från en oförändrad perifer zon av körteln. Oregelbunden form, diffus spridning med masseffekt, suddiga och ojämna konturer är morfologiska egenskaper hos fokus med låg signalintensitet i prostatakörtelns perifera zon, vilket tyder på en neoplastisk natur hos lesionen. Vid dynamisk kontrast ackumuleras kontrastmedlet snabbt i arteriernas fas och avlägsnas snabbt, vilket återspeglar graden av angiogenes och därmed graden av tumörmalignitet. Låg signalintensitet är också karakteristisk för postbiopsiblödningar, prostatit, stromal benign hyperplasi i körtelns neutrala zon, fibrösa-ärrförändringar, fibromuskulär hyperplasi, konsekvenser av hormonell eller strålbehandling. MR utan dynamisk kontrast möjliggör inte tillförlitlig differentiering av de flesta av de listade förändringarna och sjukdomarna.
Som nämnts ovan är en av huvuduppgifterna för alla avbildningsmetoder för prostatacancer att bestämma volymen av körtellesionen och tumörens spridning bortom kapseln. Att bestämma tumörvolymen är viktigt för prognosen. En tumörvolym på mindre än 4 cm3 indikerar avlägsna metastaser, och 12 cm3 indikerar en extremt hög sannolikhet för metastaser. Enligt forskning varierar noggrannheten hos MR för att detektera foci av neoplastiska lesioner i prostata från 50 till 90%. Känsligheten hos MR för att bestämma lokaliseringen av prostatacancer är cirka 70-80%, medan mikroskopiska cancerfokus (foci) inte kan detekteras med MR.
Den viktigaste fördelen med endorektal MR är möjligheten att lokalisera neoplastiska lesioner i områden som är oåtkomliga för andra diagnostiska metoder och att klargöra tumörtillväxtens natur och riktning. MR möjliggör till exempel att detektera neoplastiska lesioner i de främre delarna av prostatakörtelns perifera zon, vilka inte är tillgängliga med transrektal biopsi. Generellt sett kompletterar MR avsevärt data från DRE och TRUS om tumörlokalisering.
Endorektal MR möjliggör visualisering av körtelkapseln, kärl-nervknippen, sädesblåsorna, körtelspetsen, den periprostatiska venösa plexusen och bestämning av den lokala prevalensen av körteltumören. Det bör betonas att kapselpenetration betraktas som ett mikroskopiskt tecken, och även moderna MR-apparater (endorektal coil) kan inte ge sådan information. Det är endast möjligt att erhålla data om tillväxt bortom körtelkapseln.
Diagnostiska kriterier för extrakapsulär extension med hjälp av MR:
- närvaron av en extrakapsulär tumör;
- ojämn kontur av körteln (deformation, vinkel);
- asymmetri av neurovaskulära buntar;
- utplåning av de rektoprostatiska vinklarna;
- bred kontakt mellan tumören och kapseln.
Den högsta specificiteten (upp till 95-98%) och noggrannheten hos MR-resultat uppnås vid undersökning av patienter med medelhög eller hög risk för extrakapsulär invasion. Man tror att extrakapsulär invasion (enligt MR-data) indikerar olämplig kirurgisk behandling och en ogynnsam prognos för sjukdomen. Hormonell eller strålbehandling påverkar inte noggrannheten vid detektion av extrakapsulär spridning av prostatatumörer. Den största svårigheten vid detektion av cancerhärdar och extrakapsulär spridning av tumörer är den höga variationen i tolkningen av tomogram av olika specialister. Den primära uppgiften för en specialist inom stråldiagnostik är att uppnå hög diagnostisk specificitet (även på bekostnad av känslighet) för att inte beröva opererbara patienter chansen till radikal behandling.
Likheten i densiteten av cancerös, hyperplastisk och normal prostatavävnad i datortomografi gör denna metod föga användbar för att bedöma tumörens lokala spridning. Invasion i sädesblåsorna är viktigare än invasion i kapslarna, men även i detta fall ger datortomografi endast information i avancerade fall. Denna metod används dock aktivt för att markera träffområdet före strålbehandling.
Den långsamma utvecklingen av stråldiagnostik i vårt land har lett till sen diagnos av prostatacancer och följaktligen till otillräcklig förekomst av radikala metoder för behandling av prostatacancer (till exempel prostatektomi), låg tillgänglighet av moderna tomografer och avsaknaden av lämpliga utbildningsprogram för specialister inom stråldiagnostik och urologer. Trots att datortomografi och magnetresonanstomografi nu är utbredda är utrustningsnivån på mottagningarna och utbildningen av specialister inom stråldiagnostik otillräcklig för att den information som erhålls ska vara avgörande för valet av behandlingsmetod för patienter med prostatacancer.
Regionala lymfkörtlar (N)
Regionala lymfkörtlar bör endast bedömas när detta direkt påverkar behandlingsstrategin (vanligtvis vid planering av radikal behandling). Höga PSA-nivåer, T2c -T3a- tumörer, dålig differentiering och perineural invasion är förknippade med en hög risk för lymfkörtelmetastaser. Bedömning av lymfkörtelstatus baserat på PSA-nivåer anses otillräcklig.
Endast lymfadenektomi (öppen eller laparoskopisk) ger den nödvändiga informationen. Nyligen genomförda studier av utökad lymfadenektomi har visat att prostatacancer inte alltid påverkar obturatorlymfkörtlarna. Vid asymptomatiska tumörer och PSA-nivåer lägre än 20 kg/ml bekräftar datortomografi (CT) förstorade lymfkörtlar endast i 1 % av fallen. Användning av MR eller CT är motiverat i fall med hög risk för metastaser, eftersom specificiteten hos dessa metoder når 93–96 %. Men även ett positivt resultat vid användning av dem kan vara falskt, och endast en punktering av en misstänkt lymfkörtel gör det möjligt att vägra lymfadenektomi. Enligt retrospektiv analys indikerar lymfkörtelns storlek inte alltid förekomsten av metastaser i den; asymmetri hos de drabbade lymfkörtlarna anses vara ett mer informativt tecken. För närvarande diagnostiseras endast 2–3 % av patienterna som har genomgått radikal prostatektomi för lokaliserad prostatacancer med metastaser till lymfkörtlarna baserat på postoperativ histologisk undersökning.
Positronemissionstomografi (PET) och scintigrafi med märkta antikroppar rekommenderas som metoder för att detektera metastaser till lymfkörtlar, men deras användning är fortfarande begränsad på grund av otillräcklig känslighet.
Partins nomogram (2001) kan användas för att bedöma risken för regional lymfkörtelpåverkan. Nomogram är matematiska algoritmer som används för en specifik patient eller en patientgrupp. Dessa tabeller gör det möjligt att bestämma sannolikheten för lokal tumörspridning (till kapseln, sädesblåsorna) och lymfkörtelpåverkan baserat på kliniskt stadium, PSA-nivå och Gleasonindex. De gör det särskilt möjligt att identifiera en patientgrupp med låg (mindre än 10 %) sannolikhet för lymfkörtelmetastaser (med en PSA-nivå över 20 ng/md, stadium T 1-2a och Gleasonindex 2-6); i denna grupp kan lymfkörtelns tillstånd inte specificeras före radikal behandling. Risken för lymfkörtelmetastaser kan också bedömas genom att detektera tumörområden med uttalad anaplasi (4-5 poäng): om sådana områden finns i fyra eller fler biopsier eller om de dominerar i minst en biopsi, når risken 20-45 %. Hos andra patienter överstiger den inte 2,5 %. Ytterligare undersökning krävs inte i sådana fall.
Fjärrmetastaser (M)
Hos 85 % av patienterna som dör av prostatacancer upptäcks lesioner i det axiella skelettet. Skelettmetastaser uppstår på grund av att cancerceller penetrerar benmärgen med blodomloppet, vilket leder till tumörtillväxt och lys av benstrukturer. Förekomsten av skelettmetastaser påverkar prognosen, och tidig upptäckt varnar läkaren för möjliga komplikationer. I 70 % av fallen kombineras metastasering med en ökning av aktiviteten hos benisoenzymet alkaliskt fosfatas (ALP). Bestämning av ALP-aktiviteten och PSA-nivån gör det i de allra flesta fall möjligt att upptäcka skelettmetastaser. Enligt multivariat analys påverkas dessa indikatorer endast av antalet skelettmetastaser. Det är viktigt att aktiviteten hos skelettisoenzymet ALP återspeglar graden av benskada mer exakt än PSA-nivån.
Scintigrafi anses vara den känsligaste metoden för att detektera skelettmetastaser (den är överlägsen radiografi och bestämning av alkalisk och sur fosfatasaktivitet). Teknetiumdifosfonater används bättre som radiofarmaceutiskt läkemedel, eftersom deras ackumulering i ben är mycket mer aktiv än i mjukvävnader. En korrelation har visats mellan en semi-kvantitativ bedömning av benskada och överlevnad. Detektion av avlägsna metastaser är möjlig i vilket organ som helst. De förekommer oftast i icke-regionala lymfkörtlar, lungor, lever, hjärna och hud. Vid motsvarande besvär och symtom används lungröntgen, ultraljud, datortomografi och magnetresonanstomografi för att detektera dem. Taktikerna för misstänkt skelettmetastas presenteras i diagrammet.
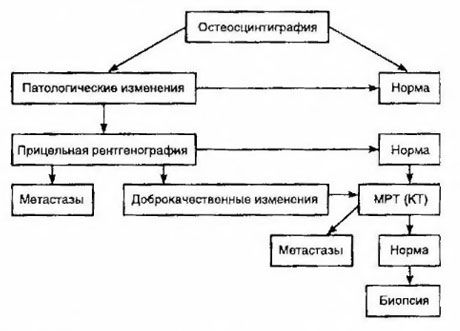
Den mest tillförlitliga laboratorieindikatorn som hjälper till att bestämma graden av metastasering är PSA-nivån. Det har visat sig att dess ökning över 100 ng/ml är den enda parametern som tillförlitligt indikerar fjärrmetastaser. Bestämning av PSA-nivån minskar antalet patienter som behöver skelettscintigrafi. Sannolikheten att upptäcka skelettmetastaser med en minskning av PSA-nivån är mycket låg. I avsaknad av besvär och med ett initialt PSA-innehåll på mindre än 20 ng/ml kan detektion av högt och måttligt differentierade tumörer undvikas. Samtidigt, vid dåligt differentierade tumörer och kapselinvasion, är scintigrafi indicerad (oavsett PSA-nivå).


 [
[