Medicinsk expert av artikeln
Nya publikationer
Mediciner
Neuroleptika eller antipsykotika
Senast recenserade: 04.07.2025

Allt iLive-innehåll är mediekontrollerat eller faktiskt kontrollerat för att säkerställa så mycket faktuell noggrannhet som möjligt.
Vi har strikta sourcing riktlinjer och endast länk till välrenommerade media webbplatser, akademiska forskningsinstitut och, när det är möjligt, medicinsk peer granskad studier. Observera att siffrorna inom parentes ([1], [2] etc.) är klickbara länkar till dessa studier.
Om du anser att något av vårt innehåll är felaktigt, omodernt eller på annat sätt tveksamt, välj det och tryck på Ctrl + Enter.
Antipsykotika (neuroleptika) är en klass av psykotropa läkemedel som främst används för att behandla schizofreni. För närvarande är det vanligt att skilja mellan två grupper (eller kategorier) av läkemedel: typiska och atypiska antipsykotika. Nedan följer information om farmakologiska egenskaper, indikationer för användning och biverkningar av behandlingen för var och en av dessa läkemedelsgrupper.
Indikationer för användning av typiska antipsykotika
För närvarande inkluderar de viktigaste indikationerna för förskrivning av traditionella neuroleptika, enligt rekommendationer från auktoritativa forskare inom psykofarmakaterapi, följande.
- Lindring av psykomotorisk agitation och beteendestörningar orsakade av svåra psykotiska symtom. I dessa fall är användning av orala eller parenterala former av läkemedel med antipsykotisk verkan indicerat, både globala (klopromazin, levomepromazin, tioproperazin, zuklopentixol) och selektiva - i form av en effekt på hallucinatoriskt-paranoida störningar (haloperidol, trifluoperazin).
- Anti-återfallsbehandling (förebyggande behandling). För detta ändamål förskrivs depotformer av läkemedel, särskilt hos patienter med dålig följsamhet till läkemedelsbehandlingen (haloperidoldekanoat, förlängd form av flupentixol), eller små eller medelstora doser av läkemedel för att uppnå en disinhibitorisk (antinegativ) effekt, bland de läkemedel vars höga doser används för att lindra akuta psykotiska störningar (flupentixol, zuklopentixol). I denna typ av behandling rekommenderas det också att förskriva så kallade små neuroleptika (tioridazin, klorprotixen, sulpirid), vars psykotropa aktivitet består i en effekt på manifestationerna av den depressiva polen och sömnlöshet.
- Att övervinna terapeutiskt resistens mot atypiska antipsykotika vid behandling av akuta psykotiska tillstånd. För detta ändamål används vanligtvis parenterala former av traditionella antipsykotika med global (klorpromazin, levomepromazin, etc.) och selektiv (haloperidol) antipsykotisk verkan.
Dessa läkemedel orsakar olika biverkningar, vars natur beror på egenskaperna hos varje läkemedels farmakologiska profil. Antipsykotika med en mer uttalad kolinolytisk effekt orsakar oftare ackommodationsstörningar, förstoppning, muntorrhet och urinretention. En sederande effekt är mer typisk för antipsykotika med en uttalad antihistamineffekt, och ortostatisk hypotoni är mer typisk för läkemedel som blockerar a1-adrenerga receptorer. Blockering av kolinerg, nordrenerg och dopaminerg transmission av typiska neuroleptika kan leda till ett antal störningar i den sexuella sfären, såsom amenorré eller dysmenorré, anorgasmi, galaktorré, svullnad och ömhet i bröstkörtlarna och minskad potens. Biverkningar i den sexuella sfären är huvudsakligen förknippade med dessa läkemedels kolinolytiska och adrenoblockerande egenskaper, och även med en ökning av prolaktinsekretion på grund av blockering av dopaminmetabolismen. De allvarligaste biverkningarna av typiska neuroleptika är motorisk dysfunktion. De är den vanligaste orsaken till att patienter slutar ta mediciner. De tre huvudsakliga biverkningarna av behandlingen i samband med påverkan på den motoriska sfären inkluderar tidiga extrapyramidala syndrom, tardiv dyskinesi och NMS.
Extrapyramidala syndrom tros vara associerade med blockad av D2-receptorer i basala ganglierna. De inkluderar dystoni, neuroleptisk parkinsonism och akatisi. Manifestationer av akut dystonisk reaktion (tidig dyskinesi) inkluderar plötsligt utvecklande hyperkinesi, okulogyriska kriser, sammandragningar av ansikts- och bålmusklerna, opistotonus. Dessa störningar är dosberoende och uppstår ofta efter 2–5 dagars behandling med högpotenta neuroleptika såsom haloperidol och flufenazin. För att lindra tidig dyskinesi minskas den neuroleptiska dosen och antikolinerga läkemedel (biperiden, trihexyfenidyl) förskrivs. Tardiv dyskinesi involverar vanligtvis nackmusklerna och är, till skillnad från akut dystonisk reaktion, mindre responsiv på behandling med antikolinergika. Neuroleptisk parkinsonism kännetecknas av minskad spontan motorik, hypo- och amimi, vilotremor och rigiditet. Det är viktigt att skilja dessa symtom från de utåt sett liknande negativa störningarna vid schizofreni, vilka representeras av emotionell alienation, avtrubbning av affekt och anergi. För att korrigera dessa biverkningar är användning av antikolinergika, en minskning av dosen av neuroleptikum eller dess ersättning med ett atypiskt antipsykotikum indicerat. Akatisi manifesteras av inre ångest, oförmåga att stanna kvar på ett ställe under lång tid och behovet av att ständigt röra armar eller ben. För att lindra detta används antikolinergika och centrala betablockerare (propranolol).
Sen dyskinesi manifesteras av ofrivilliga rörelser i vilken muskelgrupp som helst, oftast musklerna i tungan och munnen. Kliniskt urskiljs ett antal former: dyskinesi i musklerna i kinderna, tungan och munnen (periodiska sammandragningar av tuggmusklerna, vilket skapar intrycket av en grimaserande person, tungan kan ofrivilligt sticka ut från patientens mun); tardiv dystoni och tardiv akatisi; (patienten gör koreoatetoida rörelser i huvud, bål, övre och nedre extremiteter). Denna form av sjukdom registreras huvudsakligen vid långtidsbehandling med traditionella neuroleptika och upptäcks hos cirka 15-20% av patienterna som tar dem som underhållsbehandling. Förmodligen ökar risken för att utveckla dyskinesisymptom hos vissa patienter, eftersom vissa av dem observerades i schizofrenikliniken redan före den "neuroleptiska eran". Dessutom har tardiv dyskinesi beskrivits hos äldre kvinnor och patienter med affektiva störningar. Tardiv dyskinesi tros vara associerad med en ökning av antalet dopaminreceptorer i striatum, även om GABAerga och andra neurotransmittorsystem sannolikt också är involverade i dess patogenes. Det finns ingen effektiv universell behandling för sådana biverkningar. Det föreslås att låga doser av högpotenta neuroleptika med dopaminblockerande effekt eller E-vitamin kan ha en måttlig gynnsam effekt vid dessa sjukdomar. Den mest effektiva åtgärden för tardiv dyskinesi är en minskning av dosen av ett typiskt neuroleptikum eller att det ersätts med ett atypiskt antipsykotikum.
Enligt aktuella data förekommer malignt neuroleptikasyndrom i cirka 0,5 % av fallen av psykofarmakaterapi. Den sällsynta förekomsten av en sådan livshotande komplikation kan för närvarande förklaras av den utbredda användningen av atypiska antipsykotika, eftersom risken att utveckla neuroleptika (NMS) under behandling med dessa läkemedel är obetydlig. Det är allmänt accepterat att den främsta orsaken till NMS-utveckling är överdriven blockad av det dopaminerga systemet under behandling med neuroleptika, särskilt efter ökad dos av ett mycket potent antipsykotikum. De viktigaste symtomen på NMS är hypertermi, ökad tonus i skelettmuskler och senreflexer, nedsatt medvetandegrad med övergång till koma. Blodprover visar leukocytos, ökad erytrocytsedimentationshastighet, levertransaminasaktivitet; urinprover visar förekomst av albuminuri. Vatten- och elektrolytbalansstörningar uppstår snabbt, vilket skapar förutsättningar för bildandet av hjärnödem. NMS är ett akut tillstånd som kräver akut sjukhusvistelse för intensiv infusionsbehandling. Vid behandling av NMS är hydrering och symtomatisk behandling viktigast. I denna situation kräver alla förskrivna neuroleptika omedelbart utsättning. I vissa fall har dopaminreceptoragonister (till exempel bromokriptin) eller muskelavslappnande medel en positiv effekt, även om deras effektivitet inte har studerats. Efter eliminering av NMS bör neuroleptikum inte återupptas på minst två veckor. Därefter kan ett lågpotent antipsykotikum förskrivas, helst ett läkemedel av den nya generationen. Dosen av det nyligen förskrivna läkemedlet bör ökas extremt noggrant, med övervakning av vitala funktioner och laboratoriedata (blod- och urintester).
Typiska neuroleptika orsakar sällan farliga, dödliga komplikationer. Överdosmanifestationer är huvudsakligen relaterade till den individuella profilen av läkemedlets antiadrenerga och antikolinerga effekt. Eftersom dessa läkemedel har en stark antiemetisk effekt, är magsköljning indicerat för deras eliminering från kroppen, snarare än administrering av emetika. Arteriell hypotoni är som regel en konsekvens av adrenerga receptorblockad, och den bör korrigeras genom administrering av dopamin och noradrenalin. Vid hjärtrytmrubbningar är användning av lidokain indicerat.
Verkningsmekanism och farmakologiska effekter av typiska antipsykotika
I takt med att psykofarmakologin utvecklades föreslogs olika alternativ för antipsykotikas effekt på neuroreceptorer. Huvudhypotesen kvarstår att de påverkar dopamins neurostrukturer (främst D2-receptorer), baserat på data om störningar i normal dopaminmetabolism i hjärnstrukturer vid psykoser. Dopamin D2-receptorer finns i basala ganglierna, nucleus accumbens och frontala cortex; de spelar en ledande roll i regleringen av informationsflödet mellan hjärnbarken och talamus.
Figuren visar en mer detaljerad förståelse av störningarna i dopamintransmissionen i hjärnans kortikala och subkortikala områden och vilken roll dessa störningar spelar i utvecklingen av schizofrenisymtom (anpassad från monografin av Jones RB, Buckley PF, 2006).
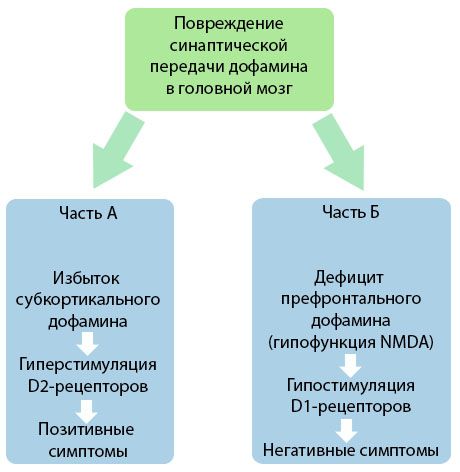
Del A återspeglar den klassiska, tidiga dopaminteorin, som postulerar ett överskott av dopamin i subkortikala områden och hyperstimulering av D2-receptorer, vilket leder till uppkomsten av produktiva symtom. Del B demonstrerar den efterföljande moderniseringen av teorin i början av 1990-talet. Data som erhållits vid denna tidpunkt visade att en brist på dopamin i D2-receptorer, tillsammans med otillräcklig stimulering av dessa receptorer i prefrontala cortex, leder till uppkomsten av negativa symtom och kognitiva brister. Därför, enligt modern förståelse, är båda typerna av dopaminerga transmissionsstörningar - ett överskott av subkortikal dopamin och dess brist i prefrontala cortex - det kombinerade resultatet av en störning av synaptisk transmission i prefrontala området och är associerade med N-metyl-N-aspartat-hypofunktion. Förutom den initialt isolerade dopaminen identifierades senare andra neurotransmittorer som är involverade i patogenesen av schizofreni, såsom serotonin, gamma-aminosmörsyra, glutamat, noradrenalin, acetylkolin och olika neuropeptider. Även om dessa mediatorers roll inte har studerats fullt ut, blir det ändå, allt eftersom kunskapen utvecklas, tydligt att de manifesterar ett flertal neurokemiska förändringar i kroppen. Därför är den kliniska effekten av ett antipsykotiskt läkemedel en sammanfattning av effekterna på olika receptorbildningar och leder till eliminering av homeostasrubbningar.
Under senare år, tack vare framväxten av nya forskningsmetoder som radioisotopligandbindning och PET-skanning, har betydande framsteg gjorts när det gäller att belysa den fina biokemiska verkningsmekanismen för neuroleptika. I synnerhet har den jämförande styrkan och tropismen hos läkemedel som binder till enskilda neuroreceptorer i olika områden och strukturer i hjärnan fastställts. Ett direkt beroende av svårighetsgraden av ett läkemedels antipsykotiska effekt på styrkan av dess blockerande effekt på olika dopaminerga receptorer har visats. Nyligen har fyra typer av sådana receptorer identifierats:
- D1 är huvudsakligen belägna i området kring substantia nigra och striatum (den så kallade nigrostriatala regionen), såväl som den prefrontala regionen;
- D2 - i nigrostriatala, mesolimbiska regioner och den främre hypofysen (utsöndring av prolaktin);
- D3 (presynaptisk) - i olika hjärnstrukturer, kontrollera dopaminerg aktivitet enligt lagen om negativ feedback;
- D4 (presynaptisk) - främst i de nigrostriatala och mesolimbiska områdena.
Samtidigt kan det nu anses bevisat att det är blockaden av D2-receptorer som orsakar utvecklingen av antipsykotiska, sekundära sederande effekter, såväl som extrapyramidala biverkningar. Andra kliniska manifestationer av blockaden av denna typ av receptorer är den smärtstillande och antiemetiska effekten av neuroleptika (minskning av illamående, kräkningar som ett resultat av hämning av kräkningscentrum), samt en minskning av innehållet av tillväxthormon och en ökning av produktionen av prolaktin (neuroendokrina biverkningar, inklusive galaktorré och menstruationsrubbningar). Långvarig blockad av nigrostriatala D2-receptorer leder till uppkomsten av deras överkänslighet, vilket är ansvarigt för utvecklingen av tardiva dyskinesier och "överkänslighetspsykoser". Troliga kliniska manifestationer av blockaden av presynaptiska D3- och D4-receptorer är huvudsakligen förknippade med den stimulerande effekten av neuroleptika. På grund av den partiella blockaden av dessa receptorer i de nigrostriatala och mesolimbokortikala områdena kan aktiverande och incisiva (kraftfulla, högaktiva) neuroleptika i små doser stimulera, och i höga doser undertrycka, dopaminerg transmission.
Under senare år har intresset för funktionen hos hjärnans serotonerga system, inklusive serotoninreceptorer, ökat kraftigt. Faktum är att det serotonerga systemet i olika delar av hjärnan har en modulerande effekt på dopaminerga strukturer. Särskilt i den mesokortikala regionen hämmar serotonin frisättningen av dopamin, och följaktligen leder blockaden av postsynaptiska 5-HT-receptorer till en ökning av dopaminhalten. Som känt är utvecklingen av negativa symtom vid schizofreni förknippad med hypofunktion av dopaminneuroner i hjärnbarkens prefrontala strukturer. För närvarande är cirka 15 typer av centrala 5-HT-receptorer kända. Det har experimentellt upptäckts att neuroleptika binder huvudsakligen till 5-HT-receptorer av de tre första typerna.
Dessa läkemedel har en huvudsakligen stimulerande (agonistisk) effekt på 5-HT1a-receptorer. Troliga kliniska konsekvenser: ökad antipsykotisk aktivitet, minskad svårighetsgrad av kognitiva störningar, korrigering av negativa symtom, antidepressiv effekt och minskad incidens av extrapyramidala biverkningar.
Neuroleptikas effekt på 5-HT2-receptorer, särskilt på 5-HT2a-subtyper, är av betydande betydelse. De finns huvudsakligen i hjärnbarken och deras känslighet är ökad hos patienter med schizofreni. Förmågan hos den nya generationens neuroleptika att minska svårighetsgraden av negativa symtom, förbättra kognitiva funktioner, reglera sömnen genom att öka den totala varaktigheten av långsamma sömnstadier (D-våg), minska aggression och lindra depressiva symtom och migränliknande (som uppstår vid cerebrovaskulära sjukdomar) huvudvärk är förknippad med blockaden av 5-HT2a-receptorer. Å andra sidan är blockaden av 5-HT2a-receptorer möjliga för hypotensiva effekter och ejakulationstörningar hos män.
Man tror att effekten av neuroleptika på 5-HT2c-receptorer orsakar en lugnande (ångestdämpande) effekt, ökad aptit (åtföljd av en ökning av kroppsvikt) och en minskning av prolaktinproduktionen.
5-HT3-receptorer är huvudsakligen belägna i den limbiska regionen, och när de blockeras utvecklas den antiemetiska effekten först, och de antipsykotiska och anxiolytiska effekterna förstärks också.
Förekomsten av Parkinsonism-liknande symtom beror också på läkemedlets blockerande kraft på muskarina kolinerga receptorer. Kolinolytiska och dopaminblockerande effekter är till viss del i ömsesidiga relationer. Det är till exempel känt att D2-receptorer i den nigrostriatala regionen hämmar frisättningen av acetylkolin. När mer än 75 % av D2-receptorerna i den nigrostriatala regionen är blockerade, störs balansen till förmån för det kolinerga systemet. Detta är anledningen till den korrigerande effekten av antikolinerga läkemedel (korrigerare) på neuroleptiska extrapyramidala biverkningar. Klorprotixen, klozapin och olanzapin har en hög affinitet för muskarina receptorer och orsakar praktiskt taget inga extrapyramidala biverkningar, eftersom de blockerar kolinerga och dopaminerga receptorer samtidigt. Haloperidol och piperazin-fenotiazinderivat har en uttalad effekt på dopaminreceptorer, men har en mycket svag effekt på kolinreceptorer. Detta beror på deras förmåga att orsaka uttalade extrapyramidala biverkningar, vilka minskar vid användning av mycket höga doser när den kolinolytiska effekten blir märkbar. Förutom att minska den dopaminblockerande effekten på D2-receptorer i den nigrostriatala regionen och utjämna extrapyramidala biverkningar, kan en stark kolinerg effekt orsaka försämring av kognitiva funktioner, inklusive minnesstörningar, såväl som perifera biverkningar (torra slemhinnor, nedsatt synförmåga, förstoppning, urinretention, förvirring, etc.). Neuroleptika har en ganska stark blockerande effekt på typ I-histaminreceptorer, vilket i första hand är förknippat med svårighetsgraden av den sederande effekten, samt en ökning av kroppsvikt på grund av ökad aptit. De antiallergiska och klådstillande effekterna av neuroleptika är också förknippade med deras antihistaminegenskaper.
Förutom dopaminblockerande, antiserotonerga, kolinolytiska och antihistamina effekter har de flesta neuroleptika adrenolytiska egenskaper, dvs. de blockerar både centrala och perifera a1-adrenoreceptorer. Adrenoblockerare som klorpromazin och klorprotixen har en uttalad sederande effekt. Dessutom kan den blockerande effekten av dessa läkemedel orsaka neurovegetativa biverkningar (arteriell hypotoni, takykardi etc.), samt en ökning av den hypotensiva effekten av adrenoblockerare.
Ett stort antal författares arbeten ger data om bindningsstyrkan (affiniteten) hos enskilda neuroleptika med olika typer av neuroreceptorer.
Baserat på deras neurokemiska verkningsprofil kan typiska och atypiska antipsykotika, bland de som huvudsakligen används i klinisk praxis, villkorligt delas in i sex grupper.
Den första gruppen består av selektiva blockerare av D2- och D4-receptorer (sulpirid, amisudprid, haloperidol, etc.) från grupperna av bensamid- och butyrofenonderivat. I små doser, främst på grund av blockering av presynaptiska D4-receptorer, aktiverar de dopaminerg överföring av nervimpulser och har en stimulerande (disinhibitorisk) effekt, i stora doser blockerar de D2-receptorer i alla delar av hjärnan, vilket kliniskt manifesteras av en uttalad antipsykotisk effekt, såväl som extrapyramidala och endokrina (på grund av prolaktinemi) biverkningar.
Den andra gruppen inkluderar högaktiva D2-receptorblockerare, såväl som läkemedel som svagt eller måttligt blockerar 5-HT2a- och 5-HT1a-receptorer (flupentixol, flufenazin, zuklopentixol, etc.), dvs. huvudsakligen piperazinderivat av fenotiazin eller tioxantener som ligger nära dem i stereokemisk struktur. Liksom läkemedlen i den första gruppen har dessa neuroleptika först och främst en uttalad antipsykotisk (incidiv) effekt, och orsakar även extrapyramidala pye-effekter och prolaktinemi. I små doser har de en måttligt aktiverande (psykostimulerande) effekt.
Den tredje gruppen består av polyvalenta sederande neuroleptika som blockerar de flesta neuroreceptorer på ett odifferentierat sätt. Dessa läkemedel har en tydligt uttalad blockerande effekt på dopaminreceptorer och orsakar även starka adrenolytiska och kolinolytiska effekter. Detta inkluderar de flesta sederande neuroleptika, främst alifatiska och piperidinderivat av fenotiazin, såväl som tioxantener som är nära dem i stereokemisk struktur (klorpromazin, levomepromazin, klorprotixen, etc.). Spektrumet av psykotrop aktivitet hos dessa läkemedel domineras först och främst av en uttalad primär sederande effekt, som utvecklas oavsett vilken dos som används, och en måttlig antipsykotisk effekt. Dessutom, på grund av deras uttalade antikolinerga effekt, orsakar läkemedel i denna grupp svaga eller måttliga extrapyramidala och neuroendokrina biverkningar, men leder ofta till utveckling av ortostatisk hypotoni och andra autonoma reaktioner på grund av uttalad blockad av a1-adrenerga receptorer.
Den fjärde gruppen omfattar neuroleptika som blockerar D2- och 5-HT2a-receptorer på ett balanserat sätt, dvs. i samma utsträckning (den senare i något större utsträckning) och a1-adrenoreceptorer i måttlig utsträckning. Denna grupp omfattar representanter för den nya generationen av atypiska antipsykotika (risperidon, ziprasidon, sertindol), vilka har olika kemiska strukturer. Den neurokemiska verkningsmekanismen avgör deras selektiva inverkan främst på hjärnans mesolimbiska och mesokortikala områden. Tillsammans med en tydlig antipsykotisk effekt, frånvaro eller svagt uttryck av extrapyramidala biverkningar (vid användning av terapeutiska doser), svag eller måttlig prolaktinemi och måttliga adrenolytiska egenskaper (hypotensiva reaktioner), kan denna grupp av neuroleptika korrigera negativa symtom genom indirekt stimulering av dopaminerg transmission i hjärnbarken.
Den femte gruppen består av polyvalenta atypiska antipsykotika med tricyklisk dibensodiazepin eller liknande struktur (klozapin, olanzapin och quetiapin). Precis som läkemedlen i den tredje gruppen blockerar de de flesta neuroreceptorer på ett odifferentierat sätt. Emellertid blockeras 5-HT2a-receptorer starkare än D2- och D4-receptorer, särskilt de som är belägna i den nigrostriatala regionen. Detta avgör den faktiska frånvaron eller svaga extrapyramidala effekten och frånvaron av neuroendokrina biverkningar i samband med ökad prolaktinproduktion med en tydlig antipsykotisk effekt och förmågan att minska svårighetsgraden av negativa symtom. Dessutom har alla läkemedel i denna grupp uttalade adrenolytiska och antihistaminiska egenskaper, vilket avgör de sederande och hypotensiva effekterna. Klozapin och olanzapin har också en ganska uttalad blockerande effekt på muskarinreceptorer och leder till utveckling av kolinolytiska biverkningar.
Således är förmågan att blockera postsynaptiska dopaminerga receptorer med en kompensatorisk ökning av syntesen och metabolismen av dopamin den enda gemensamma biokemiska egenskapen för alla neuroleptika som beaktas i dessa grupper.
Den sjätte gruppen inkluderar det enda atypiska antipsykotikumet, aripiprazol, som relativt nyligen har dykt upp på den inhemska psykofarmakamarknaden. Detta läkemedel är en partiell agonist av D2-dopaminreceptorer och fungerar som en funktionell antagonist i ett hyperdopaminergt tillstånd och som en funktionell agonist i en hypodopaminerg profil. En sådan unik receptorprofil för aripiprazol gör det möjligt att minska risken för extrapyramidala störningar och hyperprolaktinemi vid användning. Dessutom fungerar aripiprazol som en partiell agonist av 5-HT1a-receptorer och samtidigt en antagonist av 5-HT2a-receptorer. Det antas att sådan interaktion med receptorer leder till en generellt balanserad funktion av serotonin- och dopaminsystemen, så verkningsmekanismen för aripiprazol kan betecknas som stabilisering av dopamin-serotoninsystemet.
Således tillåter den nuvarande kunskapsnivån om neuroleptikas neurokemiska verkningsmekanismer oss att föreslå en ny, patogenetiskt mer underbyggd farmakodynamisk klassificering av denna grupp av psykotropa läkemedel. Användningen av denna klassificering gör det möjligt för oss att i stor utsträckning förutsäga spektrumet av psykotrop aktivitet, tolerans och sannolika läkemedelsinteraktioner för ett visst läkemedel. Med andra ord, egenskaperna hos ett läkemedels neurokemiska aktivitet avgör i hög grad egenskaperna hos dess kliniska aktivitet, vilket bör användas vid val av ett visst antipsykotiskt läkemedel för en specifik patient.
Effektiviteten av den globala antipsykotiska effekten av alla neuroleptika uppskattas med hjälp av den så kallade klorpromazinekvivalenten, som tas som 1. Till exempel är klorpromazinekvivalenten av haloperidol = 50. Detta innebär att den antipsykotiska effekten av 1 mg haloperidol är jämförbar med 50 mg klorpromazin. Baserat på denna indikator har en klassificering utvecklats som möjliggör fördelning av neuroleptika med hög (klorpromazinekvivalent> 10,0), medelhög (klorpromazinekvivalent = 1,0-10,0) och låg (klorpromazinekvivalent = 1,0) antipsykotisk aktivitet, kallad patentitet. Typiska neuroleptika (första generationens antipsykotika) har använts i stor utsträckning inom klinisk psykofarmakoterapi i nästan ett halvt sekel. Deras terapeutiska aktivitetsspektrum inkluderar:
- global antipsykotisk verkan i form av förmågan att jämnt och differentiellt minska olika manifestationer av psykos:
- primär sederande (hämmande) effekt - läkemedlens förmåga att snabbt lindra psykomotorisk agitation;
- selektiv, selektiv antipsykotisk verkan, manifesterad i förmågan att påverka individuella symtom: delirium, hallucinationer, avhämning av drifter, etc.;
- aktiverande (disinhibitorisk, disinhibitorisk, antiautistisk) neurotropisk verkan, manifesterad genom utveckling av extrapyramidala symtom;
- somatotropisk verkan i form av utveckling av neuroendokrina och vegetativa biverkningar;
- depressiv effekt, uttryckt i vissa antipsykotikas förmåga att orsaka depressiva symtom.
Effektiviteten hos första generationens antipsykotika vid behandling av inte bara psykotiska störningar, utan även störningar inom borderlinepsykiatrin har bevisats många gånger och är obestridlig. Därför, trots den höga frekvensen av biverkningar av behandling när de förskrivs, fortsätter de att användas i medicinsk praxis.
Atypiska antipsykotika
Moderna riktlinjer innehåller data om fördelarna med att använda andra generationens antipsykotika i farmakoterapi. Termen "atypisk" (synonym - andra generationens antipsykotika) är villkorlig och används huvudsakligen för att underlätta beteckningen av den nya generationen. Jämfört med traditionella neuroleptika är läkemedel i denna grupp mer effektiva för att korrigera negativa, affektiva och kognitiva störningar, vilket kombineras med bättre tolerans och en lägre risk för extrapyramidala symtom. Skillnader i den terapeutiska effekten av ett eller annat läkemedel från en serie atypiska antipsykotika förklaras, liksom i gruppen av typiska neuroleptika, av dess individuella farmakologiska verkningsprofil.
För att klargöra möjligheterna till psykofarmakaterapi med atypiska antipsykotika är det lämpligt att fokusera på läkemedel i denna grupp som är registrerade i Ryssland.
 [ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
[ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
Klozapin (dibensodiazepin)
Grundaren av gruppen atypiska antipsykotika. Verkningsmekanismen för klozapin kännetecknas av en lätt blockad av D2-receptorer med samtidig hög antagonism mot 5-HT2a-receptorer, a1-, a2-adrenerga och H1-histaminreceptorer. Det har visat sig vara ett effektivt antipsykotikum vid resistens mot andra antipsykotika (ett läkemedel i reservgruppen) och är även indicerat för behandling av kronisk mani, psykotisk agitation och aggression. I hushållspraxis förskrivs klozapin ofta för att uppnå sedering och som hypnotikum hos psykotiska patienter. Det bör inses att sådan användning av klozapin inte motsvarar dess huvudsakliga indikationsprofil för användning i terapi. Förmodligen bör inställningen till detta antipsykotikum som ett läkemedel av sekundär betydelse revideras, eftersom det idag är det enda läkemedlet med bevisad effektivitet hos resistenta patienter.
Klozapin, till skillnad från typiska neuroleptika, orsakar inte allvarliga extrapyramidala störningar på grund av den tidigare nämnda låga affiniteten för O2-receptorer. Det visade sig också att det kan användas för att behandla sen dystoni och svår akatisi. På grund av den låga risken för att utveckla NMS kan klozapin betraktas som ett läkemedel att föredra för patienter som tidigare har lidit av denna komplikation.
Emellertid kan ett antal allvarliga biverkningar utvecklas under klozapinbehandling. Den farligaste av dem (även när små doser förskrivs) är agranulocytos, vilket förekommer hos 0,5–1,0 % av patienterna. Andra viktiga biverkningar som kan uppstå vid användning av läkemedlet inkluderar dåsighet, hypersalivation och viktökning, som ofta redan är förhöjd när klozapin förskrivs under påverkan av tidigare antipsykotisk behandling. Uppmärksamhet bör också ägnas åt möjligheten att utveckla takykardi, arteriell hypotoni och epileptiska anfall vid användning. Sannolikheten för anfall beror på dosen. Risken för dem ökar avsevärt om klozapindosen överstiger 600 mg/dag. Utveckling av anfall är inte en kontraindikation för vidare användning av läkemedlet, utan kräver en halvering av dosen och förskrivning av antikonvulsiva medel, såsom valproinsyra. Förebyggande av biverkningar av klozapinbehandling inkluderar noggrann övervakning av vita blodkroppar, samt EKG- och endokrina parametrar.
Överdosering av klozapin kan orsaka medvetandesänkning upp till koma, samt symtom i samband med den kolinolytiska effekten (takykardi, delirium), epileptiska anfall, andningsdepression och extrapyramidala syndrom. Dödlig utgång kan inträffa vid intag av en dos som överstiger 2500 mg av läkemedlet.
 [ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ], [ 41 ]
[ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ], [ 41 ]
Risperidon
Ett bensisoxazolderivat med hög affinitet för serotonin- och dopamin Dj-receptorer med en dominerande effekt på serotoninsystemet. Läkemedlet har ett brett spektrum av indikationer för användning, inklusive lindring av exacerbationer, behandling mot återfall, behandling vid den första psykotiska episoden och korrigering av negativa symtom på schizofreni. Läkemedlet har visat sig förbättra kognitiv funktion hos patienter med schizofreni. Preliminära data har erhållits som visar att risperidon också minskar samsjuklighet hos patienter med schizofreni och kan vara ett läkemedel att föredra vid behandling av bipolära affektiva störningar.
Biverkningar av risperidonbehandling, särskilt extrapyramidala störningar, är dosberoende och förekommer oftare vid doser överstigande 6 mg/dag. Andra biverkningar inkluderar illamående, kräkningar, ångest, dåsighet och förhöjda serumprolaktinnivåer. Långvarig användning av risperidon kan leda till viktökning och utveckling av typ 2-diabetes mellitus, men med en lägre sannolikhet jämfört med klozapin och olanzapin.
Överdosering kan orsaka somnolens, epileptiska anfall, förlängning av QT-intervallet och vidgning av QRS-komplexet samt arteriell hypotoni. Fall med dödlig utgång på grund av överdosering av risperidon har beskrivits.
Läkemedlets otvivelaktiga fördel är tillgången på flytande och snabblösliga (sublinguala) former, vars användning accelererar läkemedlets inträde i patientens kropp och underlättar kontrollen över dess intag. Det finns också en förlängd form av läkemedlet - pulver för beredning av en suspension för intramuskulär administrering (consta-risperidon i mikrosfärer). Det rekommenderas för underhållsbehandling av patienter med schizofreni, särskilt för patienter med dålig följsamhet. Det är nödvändigt att ta hänsyn till det faktum att läkemedlet behöver cirka tre veckor för att komma in i blodomloppet, därför måste patienten, när behandling med consta-risperidon påbörjas, dessutom ta den orala formen av risperidon i minst 3 veckor efter den första injektionen.
Olanzapin
När det gäller farmakologisk verkan är det nära klozapin, eftersom det har en pleiomorf receptorprofil med signifikant affinitet för serotonin-, muskarin-, alfa1-adrenerga och histaminreceptorer. Olanzapins terapeutiska aktivitet har egenskaper som liknar klozapins och risperidons effektivitet vad gäller effekten på positiva, negativa och depressiva symtom på schizofreni. Samtidigt har data erhållits om olanzapins större effektivitet jämfört med andra atypiska antipsykotika hos patienter med den första psykotiska episoden och vid korrigering av kognitiva funktionsindikatorer. Det bör beaktas att i början av behandlingen med läkemedlets tablettform kan en snabb disinhibitorisk effekt uppstå med ökad psykomotorisk agitation och ångest. Därför är användning av läkemedlets injektionsform indicerad vid behandling av attacker åtföljda av svår psykomotorisk agitation.
Olanzapin orsakar sällan extrapyramidala störningar eller tardiv dyskinesi, och de vanligaste biverkningarna vid dess användning är metabola störningar och viktökning. Det har fastställts att patienter som får olanzapin ganska ofta upplever förhöjda nivåer av kolesterol, plasmalipider och en predisposition för typ 2-diabetes mellitus, men sådana effekter var lika vanliga hos patienter som fick både olanzapin och klozapin. Samtidigt har data erhållits som visar att viktökning korrelerar med ett positivt svar på olanzapin (dvs. fungerar som en viktig prognostisk indikator för behandling), och utvecklas till fetma endast hos 20-30% av patienterna som har gått upp i vikt under behandlingen.
Överdosering kan orsaka sedering, toxiska antikolinerga effekter, epileptiska anfall och arteriell hypotoni. Det finns för närvarande inga övertygande data för att bedöma risken för dödsfall vid överdosering.
Quetiapin
Det klassificeras som en dibensotiazepinförening. Dess receptorprofil liknar i stort sett klozapins. Bindningsnivån av quetiapin till D2-receptorer är låg (mindre än 50 %) och kortvarig även vid höga doser. Läkemedlet är effektivt vid behandling av positiva, negativa och allmänna symtom på schizofreni. Det finns bevis för dess framgångsrika användning både i fall av hög resistens mot behandling och för att förbättra patienters kognitiva funktion, vilket ger rätt att rekommendera det som ett förstahands antipsykotikum för underhållsbehandling av schizofreni. Slutligen har quetiapin en måttlig antidepressiv, aktiverande effekt. Därför är det indicerat för behandling av depressiva-vanföreställningsattacker och störningar i den senesto-hypokondriska cirkeln.
Quetiapins etablerade höga tymotropa aktivitet förklarar varför det är registrerat som ett medel för lindring och sekundärprevention av depressiva störningar. För behandling av maniska episoder inom bipolära störningar av typ I och II används quetiapin som ett ytterligare medel. Avsaknaden av injektionsformer begränsar dess användning något hos patienter med agitation och aggressivt beteende.
Quetiapin tolereras väl, det orsakar praktiskt taget inte extrapyramidala syndrom, förutom i fall där maximala doser används. Quetiapin orsakar inte hyperprolaktinemi, mer sällan än olanzapin och klozapin leder det till viktökning och nedsatt glukostolerans.
Ziprasidon
Har en unik profil av receptoraktivitet. Som en potent antagonist av 5HT2a-receptorer och D2-receptorer är det också en aktiv hämmare av serotonin- och noradrenalinåterupptag. Kliniska studier har visat signifikant överlägsenhet av ziprasidon i dess effekt på psykotiska symtom och manifestationer av aggression jämfört med haloperidol. Det finns också data om den positiva effekten av ziprasidon på kognitiva funktioner hos patienter med schizofreni, såväl som på samsjukliga affektiva symtom, indikatorer på social funktion. Ziprasidon tolereras vanligtvis väl och orsakar mycket sällan extrapyramidala syndrom, viktökning och metabola störningar. Oftare ses en förlängning av QT-intervallet över 460 ms, därför är det lämpligt för patienter som får detta läkemedel att genomgå en EKG-undersökning både innan läkemedlet förskrivs och kontrollövervakning under behandlingen. Särskild uppmärksamhet bör ägnas åt samtidig behandling (intag av antiarytmika), vilket kan förvärra förlängningen av QT-intervallet och leda till utveckling av hjärtrytmrubbningar, ventrikelflimmer.
Sertindol
Tillhör derivat av fenylindol. Det har hög funktionell antagonism i förhållande till D2-, serotonin- (särskilt 5-HT2a-receptorer) och a1-adrenerga receptorer. Enligt elektroneurokemiska studier hämmar sertindol selektivt dopaminreceptorer i den ventrala segmentregionen. Sådan selektivitet säkerställer med all sannolikhet en låg risk för extrapyramidala syndrom och hyperprolaktinemi vid användning av läkemedlet. Resultaten av jämförande studier har visat att sertindol är jämförbart med haloperidol vad gäller antipsykotisk aktivitet. Läkemedlet har en uttalad hämmande effekt hos patienter med negativa och depressiva symtom, vilket är överlägset en liknande effekt av rispolept. Det finns också bevis som bekräftar sertindols effektivitet för att korrigera kognitiv nedsättning hos patienter med schizofreni. Sertindol tolereras generellt väl av patienter, orsakar sällan sedering och rekommenderas därför som ersättningsläkemedel när biverkningar uppstår under behandling med andra moderna antipsykotika.
Allvarliga biverkningar inkluderar läkemedlets förmåga att förlänga QT-intervallet, vilket kan leda till hjärtarytmi. Vid analys av studier efter marknadsföring blev det tydligt att sertindols hjärtprofil inte skiljer sig från den för andra antipsykotika av den nya generationen.
Aripiprazol
Det har antipsykotisk aktivitet jämförbar med andra atypiska medel, men har en större effekt på parametrarna för kognitiv funktion hos patienter med schizofreni. Läkemedlets ovan nämnda unika farmakologiska verkan - en partiell agonist av D2-receptorer - gör det möjligt att minska risken för extrapyramidala syndrom och hyperprolaktinemi vid användning.
 [ 42 ], [ 43 ], [ 44 ], [ 45 ], [ 46 ], [ 47 ]
[ 42 ], [ 43 ], [ 44 ], [ 45 ], [ 46 ], [ 47 ]
Amisulprid
Tillhör klassen substituerade bensamider. Läkemedlet binder selektivt till subtyperna av D2- och D3-dopaminerga receptorer, har ingen affinitet för subtyperna D1, D4 och D5, såväl som för serotonin-, H1-histamin-, a1-adrenerga och kolinerga receptorer. Vid användning i höga doser blockerar det postsynaptiska D2-receptorer. I låga doser manifesteras dess disinhibitoriska effekt på grund av blockering av presynaptiska D2-, D3-receptorer, vilket gör att dess användning också är effektiv vid behandling av negativa symtom, även om det inte är en kombinerad antagonist av D2-receptorer och serotoninreceptorer. Resultaten av ett antal studier indikerar en uttalad antipsykotisk aktivitet hos läkemedlet vid användning i höga doser, vilket är överlägset traditionella läkemedel.
 [ 48 ], [ 49 ], [ 50 ], [ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ]
[ 48 ], [ 49 ], [ 50 ], [ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ]
Biverkningar av antipsykotisk behandling
Tabellen listar de viktigaste biverkningarna av atypisk antipsykotisk behandling.
Förberedelse |
Extrapyramidala |
Ledningsstörning på EKG |
Metaboliska störningar (viktökning, förhöjda nivåer av glukos, kolesterol, triglycerider i blodet) |
||
Klozapin |
. |
++ |
++ |
++- |
|
Risperidon |
++ |
+/- |
++ |
+/- |
|
Olanzapin |
+ |
+/- |
+++ |
++ |
+++ |
Quetiapin |
+/- |
+ |
+/- |
--- |
|
Ziprasidon |
+ |
++ |
+/- |
+/- |
+/- |
Sertindol |
++ |
-- |
+/- |
-- |
|
Ariliprazol |
-- |
--- |
+/- |
-- |
-- |
Amisulprid |
++ |
+/- |
|||
Obs. Allvarlighetsgrad av biverkningar: "+++" - hög; "++" - genomsnittlig; "+" - låg; "+/-" - tveksam; "-" - frånvarande.
Extrapyramidala syndrom
En av huvuddragen hos atypiska antipsykotika, i motsats till traditionella, är deras låga förmåga att orsaka extrapyramidala syndrom, vilket blev ett genombrott inom underhållsbehandling av schizofreni. Men som framgår av data i tabellen kan sådana symtom uppstå vid användning av enskilda läkemedel i denna serie (risperidon, amisulprid), vilket kräver särskild uppmärksamhet vid förskrivning.
 [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
EKG-avvikelser
Möjligheten att utveckla hjärtbiverkningar är ett allvarligt problem vid användning av vissa moderna antipsykotika i behandlingen. I dessa fall talar vi om förlängning av QT-intervallet, vilket kan leda till utveckling av arytmi. Ledningsstörningar, främst förlängning av QT-intervallet, observeras oftast under behandling med klozapin, sertindol, ziprasidon. Samtidig patologi i form av bradykardi, atrioventrikulärt block, hypotyreos kan bidra till uppkomsten av denna komplikation under behandling med ovan nämnda läkemedel. För närvarande rekommenderas EKG-övervakning ungefär var tredje månad hos patienter som får underhållsbehandling med atypiska antipsykotika.
 [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ]
[ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ]
Endokrina störningar
För närvarande orsakas den största oron av atypiska antipsykotiska läkemedels förmåga att orsaka viktökning. Ökad kroppsvikt, glukos- och triglyceridnivåer i blodet kan leda till metabola störningar och utveckling av typ 2-diabetes. Särskild försiktighet och veckovis övervakning av biokemiska parametrar är nödvändig under behandling med klozapin och olanzapin. Enligt J. Geddes et al. (2000), PB Jones, PF Buckley (2006) bör det erkännas som lämpligt att genomföra en grundlig undersökning av patienter innan de förskriver ett visst antipsykotikum av den moderna generationen, eftersom det är känt att metabola störningar oftare förekommer hos patienter som hade en ärftlig predisposition, övervikt, lipidspektrumrubbningar och hyperglykemi innan behandlingen påbörjades. Övervakningsalgoritmen som föreslagits av PB Jones, PF Buckley (2006) inkluderar flera punkter.
- Insamling av sjukdomshistoria och familjefaktorer gällande risken för metabola störningar.
- Registrering av kroppsmasseindex, EKG, blodtryck och puls före behandlingsstart.
- Insamling av laboratoriedata (glukos, lipidprofil, kolesterol) innan behandling påbörjas.
- Regelbunden övervakning av kroppsmasseindex och vitala tecken under behandlingen.
- Övervakning av laboratoriedata under behandling.
Förekomsten av hyperprolaktinemi under antipsykotisk behandling beror på central blockad av dopaminreceptorer i hypotalamus, vilket leder till frisättning av prolaktin från den främre hypofysen. Hyperprolaktinemi uppstår oftast vid behandling med olanzapin, risperidon och amisulprid.
 [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ]
[ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ]
Agranulocytos
En annan allvarlig komplikation av antipsykotisk behandling. Den kan observeras under behandling med klozapin och olanzapin. Enligt J. Geddes et al. (2000) diagnostiserades den under de första 3 månaderna hos 1-2% av patienterna som tar dessa läkemedel. I detta avseende rekommenderas veckovisa blodprover för patienter som tar dessa läkemedel under de första 18 veckorna av behandlingen och därefter månatlig uppföljning. Det har visats att när dosen av ovan nämnda neuroleptika minskas återgår det kliniska blodprovet till det normala. Samtidigt bör man erkänna att det hittills inte finns någon tydlig strategi för patienter som upplever ovan nämnda biverkningar i samband med metabola störningar. Oftast ersätts ett atypiskt antipsykotikum med ett annat. En annan lovande inriktning är att utse speciell korrigerande behandling, särskilt användning av bromokriptin för att korrigera hyperprolaktinemi. Den ideala situationen är en där vården av en patient med sådana störningar utförs med regelbundet involverande av internistläkare, särskilt endokrinologer, kardiologer och andra specialister.
Sammanfattningsvis bör det noteras att om de givna algoritmerna för förskrivning och övervakning av inte bara patienternas mentala utan även deras fysiska tillstånd följs, är användningen av andra generationens läkemedel säkrare än typiska neuroleptika.
Ett antal andra antipsykotika är för närvarande i utvecklingsstadiet. Nästa generations läkemedel kommer sannolikt att ha en annan verkningsmekanism (till exempel en GABAergisk profil) och kommer att kunna påverka olika manifestationer av schizofreni, inklusive egentliga deficitstörningar.
Uppmärksamhet!
För att förenkla uppfattningen av information, är denna instruktion för användning av läkemedlet "Neuroleptika eller antipsykotika " översatt och presenterat i en speciell form på grundval av officiella instruktioner för medicinsk användning av läkemedlet. Före användning läs anteckningen som kom direkt till medicinen.
Beskrivning tillhandahålls för informationsändamål och är inte en guide till självläkning. Behovet av detta läkemedel, syftet med behandlingsregimen, metoder och dos av läkemedlet bestäms enbart av den behandlande läkaren. Självmedicinering är farlig för din hälsa.

