Nya publikationer
Nyckelprotein identifierat för att förhindra förlust av benmassa vid osteoporos
Senast recenserade: 02.07.2025

Allt iLive-innehåll är mediekontrollerat eller faktiskt kontrollerat för att säkerställa så mycket faktuell noggrannhet som möjligt.
Vi har strikta sourcing riktlinjer och endast länk till välrenommerade media webbplatser, akademiska forskningsinstitut och, när det är möjligt, medicinsk peer granskad studier. Observera att siffrorna inom parentes ([1], [2] etc.) är klickbara länkar till dessa studier.
Om du anser att något av vårt innehåll är felaktigt, omodernt eller på annat sätt tveksamt, välj det och tryck på Ctrl + Enter.
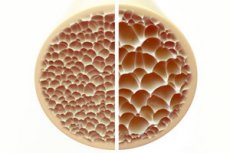
Osteoporos, ett tillstånd som kännetecknas av porösa och sköra ben, utgör ett betydande hot mot skelettets hälsa. Ben, som är det primära strukturella stödet för människokroppen, ger ett viktigt stöd. När benmassan minskar försämras inte bara detta stöd, utan även den totala funktionen, vilket leder till en minskad livskvalitet.
I takt med att förekomsten av osteoporos ökar i den åldrande befolkningen, ökar belastningen på sjukvårdens resurser för långtidsvård. Det är därför nödvändigt att förstå de mekanismer som bidrar till utvecklingen av osteoporos och att utveckla effektiva riktade behandlingar för att minimera dess långsiktiga effekter.
Osteoblaster och osteoklaster är två typer av celler som spelar en nyckelroll i underhållet och ombyggnaden av benvävnad. Medan osteoblaster är benbildande celler som ansvarar för syntes och avsättning av ny benvävnad, är osteoklaster bennedbrytande celler som är involverade i nedbrytning och borttagning av gammal eller skadad benvävnad.
En ökning av andelen osteoklaster leder till benförlust vid tillstånd som osteoporos, reumatoid artrit (inflammation i lederna) och skelettmetastaser (cancer som har spridit sig till skelettet). Osteoklaster uppstår genom differentiering av makrofager eller monocyter, vilka är typer av immunceller.
Således kan hämning av osteoklastdifferentiering fungera som en terapeutisk strategi för att förhindra benförlust. Emellertid är de exakta molekylära mekanismerna som reglerar den komplexa processen för benremodellering fortfarande oklara.
I en ny studie har professor Tadayoshi Hayata, Takuto Konno och Hitomi Murachi från Tokyo University of Science, tillsammans med kollegor, undersökt den molekylära regleringen av osteoklastdifferentiering. Stimulering med receptoraktivatorn av nukleär faktor kappa B-ligand (RANKL) inducerar differentiering av makrofager till osteoklaster.
Dessutom har signalvägar för benmorfogenetiskt protein (BMP) och transformerande tillväxtfaktor (TGF)-β visat sig vara involverade i regleringen av RANKL-medierad osteoklastdifferentiering. I den aktuella studien syftade forskarna till att undersöka rollen av Ctdnep1, ett fosfatas (ett enzym som avlägsnar fosfatgrupper) som har rapporterats hämma BMP- och TGF-β-signalvägar.
Studien är publicerad i tidskriften Biochemical and Biophysical Research Communications.
Professor Hayata säger: ”RANKL fungerar som en ’accelerator’ för osteoklastdifferentiering. Att köra bil kräver inte bara en gaspedal utan även bromsar. Här fann vi att Ctdnep1 fungerar som en ’broms’ i osteoklastdifferentieringen.”
Forskarna undersökte först Ctdnep1-uttryck i RANKL-behandlade musmakrofager och obehandlade kontrollceller. De observerade att Ctdnep1-uttrycket inte förändrades som svar på RANKL-stimulering. Det var dock lokaliserat till cytoplasman i granulär form i makrofager och differentierades till osteoklaster, till skillnad från dess normala perinukleära lokalisering i andra celltyper, vilket indikerar dess cytoplasmatiska funktion i osteoklastdifferentiering.
Dessutom resulterade nedreglering av Ctdnep1 (nedreglering av genuttryck) i en ökning av antalet osteoklaster positiva för tartratresistent surt fosfatas (TRAP), där TRAP är en markör för differentierade osteoklaster.
Knockout av Ctdnep1 resulterade i ökat uttryck av viktiga differentieringsmarkörer, inklusive "Nfatc1", en huvudtranskriptionsfaktor inducerad av RANKL för osteoklastdifferentiering. Dessa resultat stöder en "bromsfunktion" hos Ctdnep1, varigenom den negativt reglerar osteoklastdifferentiering. Dessutom resulterade knockout av Ctdnep1 också i ökad absorption av kalciumfosfat, vilket tyder på en hämmande roll för Ctdnep1 i benresorption.
Slutligen, även om Ctdnep1-knockout inte förändrade BMP- och TGF-β-signaleringen, uppvisade Ctdnep1-bristfälliga celler ökade nivåer av fosforylerade (aktiverade) proteiner, vilka är produkter från RANKL-signalvägen. Dessa resultat tyder på att den hämmande effekten av Ctdnep1 på osteoklastdifferentiering kanske inte medieras genom BMP- och TGF-β-signalering, utan genom nedreglering av RANKL-signalvägen och Nfatc1-proteinnivåer.
Sammantaget ger dessa resultat nya insikter i osteoklastdifferentieringsprocessen och identifierar potentiella terapeutiska mål som skulle kunna användas för att utveckla behandlingar för att minska benförlust på grund av osteoklastöveraktivitet. Förutom sjukdomar som kännetecknas av benförlust har Ctdnep1 också identifierats som en orsakande faktor i medulloblastom, en hjärntumör hos barn. Författarna är optimistiska att deras forskning kan utvidgas till andra mänskliga sjukdomar utöver benmetabolism.
Professor Hayata avslutar: ”Våra resultat tyder på att Ctdnep1 krävs för att förhindra överdriven osteoklastogenes. Dessa resultat kan ytterligare utöka vår kunskap om hur fosforylerings-defosforyleringsnätverket kontrollerar osteoklastdifferentiering och kan ge nya terapeutiska strategier för behandling av bensjukdomar i samband med överdriven osteoklastaktivitet.”
