Nya publikationer
Nya genetiska mekanismer kan vara ett terapeutiskt mål mot gliom
Senast recenserade: 02.07.2025

Allt iLive-innehåll är mediekontrollerat eller faktiskt kontrollerat för att säkerställa så mycket faktuell noggrannhet som möjligt.
Vi har strikta sourcing riktlinjer och endast länk till välrenommerade media webbplatser, akademiska forskningsinstitut och, när det är möjligt, medicinsk peer granskad studier. Observera att siffrorna inom parentes ([1], [2] etc.) är klickbara länkar till dessa studier.
Om du anser att något av vårt innehåll är felaktigt, omodernt eller på annat sätt tveksamt, välj det och tryck på Ctrl + Enter.
En studie från Shi-Yuan Chengs, PhD, professor vid Ken och Ruth Daveys avdelning för neuroonkologi vid neurologiska institutionen, har identifierat nya mekanismer bakom alternativa RNA-splitsningshändelser i gliomtumörceller som kan fungera som nya terapeutiska mål. Studiens resultat publiceras i Journal of Clinical Investigation.
"Vi har hittat ett annat sätt att behandla gliom genom alternativ splitsning och upptäckt nya måltavlor som inte tidigare har identifierats men som är viktiga för gliommalignitet", säger Xiao Song, MD, PhD, docent i neurologi och huvudförfattare till studien.
Gliom är den vanligaste typen av primär hjärntumör hos vuxna och härstammar från gliaceller, som finns i centrala nervsystemet och stödjer angränsande neuroner. Gliom är mycket resistenta mot standardbehandlingar, inklusive strålning och kemoterapi, på grund av tumörens genetiska och epigenetiska heterogenitet, vilket belyser behovet av att hitta nya terapeutiska mål.
Tidigare forskning från Cheng-laboratoriet, publicerad i tidskriften Cancer Research, visade att den viktiga splitsningsfaktorn SRSF3 är signifikant förhöjd i gliom jämfört med normala hjärnor, och SRSF3-reglerad RNA-splitsning främjar gliomtillväxt och progression genom att påverka flera cellulära processer i tumörceller.
RNA-splitsning är en process som involverar avlägsnande av introner (icke-kodande regioner av RNA) och sammanfogning av exoner (kodande regioner) för att bilda en mogen mRNA-molekyl som stöder genuttryck i en cell.
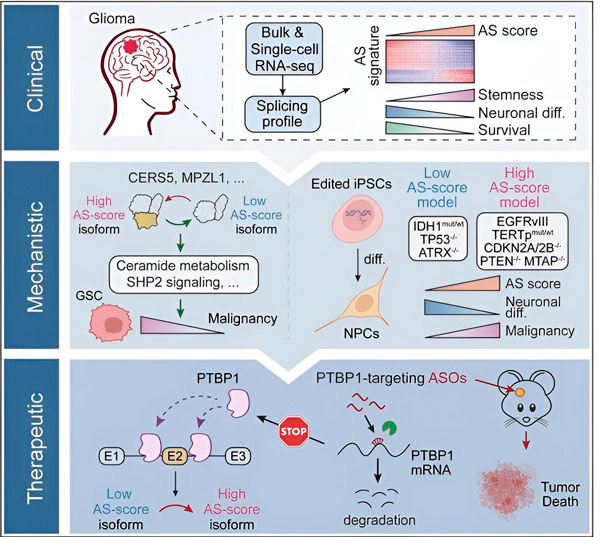
I den aktuella studien syftade forskarna till att identifiera förändringar i alternativ splitsning i gliomtumörceller, de mekanismer som ligger bakom dessa förändringar och bestämma deras potential som terapeutiska mål.
Med hjälp av beräkningsmetoder och RNA-sekvenseringstekniker undersökte forskarna splitsningsförändringar i gliomtumörceller från patientprover. För att bekräfta dessa förändringar använde de CRISPR-genredigeringstekniker för att introducera olika gliomdrivarmutationer i gliommodeller härledda från humana inducerade pluripotenta stamceller (iPSC).
De fann att dessa splitsningsförändringar förstärks av en variant av epidermal growth factor receptor III (EGFRIII), som är känd för att vara överuttryckt i många tumörer, inklusive gliom, och hämmas av en mutation i IDH1-genen.
Forskare har bekräftat funktionen hos två RNA-splitsningshändelser som skapar olika proteinisoformer med olika aminosyrasekvenser.
"Endast en av dessa isoformer kan främja tumörtillväxt, i motsats till den andra isoformen, som normalt uttrycks i den normala hjärnan. Tumörer utnyttjar denna mekanism för att selektivt uttrycka den tumörfrämjande isoformen framför den normala hjärnisoformen", sa Song.
Teamet analyserade sedan uppströms RNA-bindande proteiner och fann att PTBP1-genen reglerar tumörfrämjande RNA-splitsning i gliomceller. Med hjälp av en ortotopisk gliommodell hos immunbristfälliga möss riktade forskarna in sig på PTBP1 med antisense-oligonukleotid (ASO)-baserad terapi, vilket i slutändan hämmade tumörtillväxt.
"Våra data belyser rollen av alternativ RNA-splitsning i att påverka gliommalignitet och heterogenitet och dess potential som en terapeutisk sårbarhet för behandling av vuxna gliom", skrev studieförfattarna.
Nästa steg för forskarna är att undersöka potentialen att rikta in sig på PTBP1 för att framkalla ett antitumörimmunsvar, sa Song.
"Med hjälp av long-read RNA-sekvenseringsanalys fann vi att inriktning på PTBP1 i gliomceller resulterar i produktion av flera alternativt splitsade transkript som saknas i normala vävnader. Så vårt nästa projekt är att ta reda på om denna isoform kan generera vissa antigener så att immunförsvaret bättre kan känna igen tumören", sa Song.
Song tillade också att deras team är intresserat av att analysera splitsningsförändringar i icke-tumörceller från gliompatienter, såsom immunceller.
"Vi vet redan att splitsning är mycket viktig för att reglera funktionen i cellen, så den bör inte bara reglera tumörmalignitet, utan den kan också reglera immuncellernas funktion för att avgöra om de effektivt kan döda cancer. Så vi gör också några bioinformatiska analyser i tumörinfiltrerade immunceller för att se om det sker en förändring i splitsningen efter att en immuncell har infiltrerat tumören."
"Vårt mål är att fastställa rollen av alternativ splitsning i utformningen av den immunsuppressiva tumörmikromiljön och identifiera potentiella mål för att förbättra effekten av immunterapier vid gliom", sa Song.
