Medicinsk expert av artikeln
Nya publikationer
Gliom i hjärnan
Senast recenserade: 29.06.2025

Allt iLive-innehåll är mediekontrollerat eller faktiskt kontrollerat för att säkerställa så mycket faktuell noggrannhet som möjligt.
Vi har strikta sourcing riktlinjer och endast länk till välrenommerade media webbplatser, akademiska forskningsinstitut och, när det är möjligt, medicinsk peer granskad studier. Observera att siffrorna inom parentes ([1], [2] etc.) är klickbara länkar till dessa studier.
Om du anser att något av vårt innehåll är felaktigt, omodernt eller på annat sätt tveksamt, välj det och tryck på Ctrl + Enter.
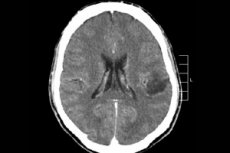
Bland de många tumörprocesserna i centrala nervsystemet diagnostiseras hjärngliom oftast - denna term är kollektiv, tumören kombinerar alla diffusa oligodendrogliala och astrocytiska foci, astrocytom, astroblastom och så vidare. En sådan tumör kan ha en annan grad av malignitet och bildas av gliastrukturer - celler lokaliserade runt neuroner. Det huvudsakliga området för gliom är hjärnhalvorna, hjärnventriklarnas väggar och chiasma - området där synnervfibrerna delvis skär. Externt är tumören ett nodulärt element med en rosa eller rödaktig nyans, rund eller spindelformad konfiguration med otydliga gränser. [ 1 ]
Epidemiologi
I cirka 5 % av fallen är gliom associerade med ärftliga patologier – i synnerhet neurofibromatos och andra syndrom med dominant nedärvning. Experter påpekar att den absoluta majoriteten av hjärngliom utvecklas sporadiskt – det vill säga utan en tydlig orsak.
Sammantaget står primära neoplasmer i centrala nervsystemet för cirka 2 % av alla tumörer, eller drygt 21 fall per hundratusen invånare. Bland dem förekommer gliom i 35–36 % av fallen, och mer än 15 % av dem är glioblastom.
Enligt vissa uppgifter drabbar gliom män oftare än kvinnor - tumören är särskilt vanlig bland personer över 50 år.
Den globala incidensen av gliom bland äldre har ökat markant under de senaste decennierna. Orsakerna till detta fenomen är ännu inte fastställda.
Enligt Världshälsoorganisationens definition har tre huvudvarianter av glialtumörer, som skiljer sig åt i sina histologiska egenskaper, identifierats. Dessa är oligodendrogliom, astrocytom och kombinerade oligoastrocytom. Incidensen av varje subtyp av lågmalign patologi har inte fastställts tillförlitligt. Vissa studier indikerar en ökning av incidensen av oligodendrogliom från 5 % till 30 % och en minskning av incidensen av astrocytom.
Gliatumörer kan infiltrera hjärnvävnad, och den stora majoriteten av låggradiga foci blir maligna inom några år. [ 2 ]
Orsaker gliom i hjärnan
Hjärngliom är en hel grupp av tumörprocesser, vars gemensamma drag är att de bildas från glialstrukturer i centrala nervsystemet som finns i hjärnvävnaden. Sådana tumörer delas in i två histopatologiska varianter: högmaligna och lågmaligna gliom.
Källan för tillväxtbildning är neurogliaceller (astrocyter, oligodendrocyter), som utgör den strukturella grunden och livskraften hos hjärnneuroner.
Gliatumörprocesser skiljer sig kraftigt åt i struktur, mutationsförändringar i gener, aggressivitet, kliniska egenskaper, diagnostiska egenskaper, behandlingsrespons och prognos hos patienter. Embryonala och ependymala neoplasmer i centrala nervsystemet – i synnerhet medulloblastom och ependymom – skiljer sig åt i sin histologiska struktur men är likartade i fråga om behandling.
Gliaelement klassificerades först som en separat strukturell kategori i nervsystemet i slutet av 1800-talet.
Neurogliavävnad består av celler som har hjälpfunktioner: trofiska, stödjande, skyddande, sekretoriska. Neuroner och gliocyter existerar tillsammans, de bildar tillsammans nervsystemet och är av stor betydelse i de allmänna processerna för organismens vitala aktivitet.
Gliocyter delas grovt in i flera huvudformer: astrocyter, oligodendrocyter, ependymala celler och mikroglia.
Hittills kan forskare inte besvara frågan om de tillförlitliga orsakerna till neurogliala tumörbildningar. Förmodligen bidrar radioaktiva effekter, infektionssjukdomar och berusning (särskilt kemisk och yrkesrelaterad) i viss mån negativt. Den ärftliga faktorn är också viktig.
Hjärngliom uppstår från onormala neurogliocyter som har en genetisk defekt som leder till onormal tillväxt och funktionalitet – sådana strukturer kallas "omogna". Ofullständiga celler är oftare belägna i ett område där tumören bildas.
Enkelt uttryckt är glialbildning resultatet av kaotisk och sporadisk tillväxt av modifierade neurogliaceller. Processen kan utvecklas från ependymocyter, oligodendrocyter, astrocyter (astrocytom, inklusive jättecells- och anaplastiska celler). [ 3 ]
Riskfaktorer
Trots att experter inte kan exakt karakterisera orsakerna till bildandet av glial onkopatologier, kan deras uppkomst i vissa fall förebyggas genom att eliminera de viktigaste riskfaktorerna:
- Joniserande strålning har cancerframkallande aktivitet, kan orsaka utveckling av leukemi och bildandet av cancerprocesser med tät struktur, även hos personer i ung ålder. Frekventa och orimliga radiologiska medicinska ingrepp, ultraviolett strålning (inklusive solarium) har också potentiella cancerframkallande effekter och kan orsaka uppkomsten av tumörer i olika organ, inklusive hjärnan.
- Yrkesrelaterade negativa effekter och berusningar har ofta ett orsakssamband med utvecklingen av cancertumörer. Produktion av gummi och glas, bekämpningsmedel och bränslen, metaller och textilier, färger och laboratoriereagenser anses vara särskilt farliga. I riskzonen finns arbetare inom flyg-, kol- och metallindustrin, kemiska och biproduktstillverkningsanläggningar, byggmaterial och elektroder, bränslen och smörjmedel, plaster och monomerer.
- Luft-, vatten- och markföroreningar står för upp till 4 % av alla cancersjukdomar i världen. Cancerframkallande ämnen, som finns i stora mängder i miljön, kommer in i kroppen via inandningsluft, dricksvatten och mat. Att bo i ekologiskt osäkra områden – nära stora industrianläggningar och trafikerade transportknutar – anses vara särskilt farligt.
- Infektionssjukdomar – i synnerhet virusinfektioner – kan också skapa gynnsamma förhållanden för utveckling av tumörer. Det är viktigt att ha detta i åtanke och att vaccinera sig i förväg, samt att förebygga infektionssjukdomar och parasitsjukdomar.
- Tobaks- och alkoholberusning anses vara riskfaktorer för många typer av cancer, inte bara hjärngliom.
- Otillräcklig fysisk aktivitet, övervikt, felaktig kost, metaboliska störningar, huvudskador, vaskulära patologier - ytterligare stressfaktorer som kan provocera uppkomsten av intracellulära störningar.
- Äldre ålder är den vanligaste perioden för utveckling av neoplasmer i kroppen, så de över 55 år bör ta särskild hand om sin egen hälsa.
Den viktigaste och mest betydande riskfaktorn för gliomutveckling är dock fortfarande ärftlig predisposition.
Patogenes
Hittills har experter ett antal antaganden om utvecklingen av hjärngliom. Varje teori har sina egna grunder, men den enda korrekta och tillförlitliga patogenetiska mekanismen har forskare ännu inte identifierat. I de flesta fall talar vi om följande faktorer i utvecklingen av neoplasmer:
Embryogenesfel, vilket består i störningar i organläggningen och bildandet av "felaktiga" cellstrukturer;
- Exponering för joniserande strålar, potentiella cancerframkallande ämnen i form av kemiska agenser, livsmedelstillsatser etc.;
- Huvudtrauma;
- Gensjukdomar som förs vidare från generation till generation ("familjärt" gliom);
- Immundysfunktion, neuroinfektioner.
De flesta gliom har diffus tillväxt, med penetration in i den omgivande normala hjärnvävnaden. Beroende på graden av malignitet kan tumören utvecklas under flera år utan några manifestationer. Vid aggressivt förlopp ökar symtomatologin snabbt under flera månader.
En del av tumörgenesen beror på dysembryogenetiska förändringar.
Hjärnstammen kan påverkas på olika nivåer: diffust hjärnstamsgliom kommer i sin tur att skilja sig både anatomiskt-morfologiskt och kliniskt. Vissa sådana neoplasmer – i synnerhet gliom i kvadriplegiplattan – kan vara relativt godartade, utan tecken på progression. Ett pontingliom, å andra sidan, kännetecknas av sin speciella malignitet, aggressivitet och dåliga prognos.
Diffusa lesioner i hjärnstrukturer, där mer än tre anatomiska zoner i de stora hjärnhalvorna är involverade i den patologiska processen, med möjlig periventrikulär divergens och passage genom corpus kallas gliomatos. [ 4 ]
Är hjärngliom ärftligt?
En välbeprövad risk för hjärngliombildning är ärftlig – det vill säga förekomsten av liknande eller andra intracerebrala tumörer hos direkta förfäder eller i samma generation. Radioaktiv exponering och regelbunden eller långvarig kontakt med potentiella cancerframkallande ämnen förvärrar situationen.
Inte bara gliom kan ärvas, utan även sjukdomar som åtföljs av ökad tumörtillväxt utan hänvisning till lokaliseringen – i synnerhet kan detta vara neurofibromatos typ 1 och 2, Li-Fraumeni syndrom, Hippel-Lindau. Ofta i gliomceller detekteras förändringar i vissa gener eller kromosomer.
De viktigaste patologierna som är förknippade med utvecklingen av gliom hos människor sammanfattas i tabellen:
Patologi |
Kromosom |
Gen |
Variation av neoplasmer |
Li-Fraumeni syndrom |
17r13 |
TR53 |
Neuroektodermala neoplasmer, astrocytom. |
Neurofibromatos |
17q11 |
NF1 |
Synnervsgliom, pilocytiskt astrocytom, neurofibromatos |
Turcottes syndrom |
15:21, 19:22 |
HMLH1, HPSM2 |
Astrocytom |
Tuberös skleros (Burnevilles syndrom). |
9q34, 16p13 |
TSC1, TSC2 |
Gigantocellulärt subependymalt astrocytom |
Oavsett gliatumörens natur, oavsett om det är ett sporadiskt fall eller en ärftlig patologi, är det en sjukdom med uttryck av en patologiskt förändrad gen. Bortsett från neoplasmer som bildats som ett resultat av inlärningseffekter, förblir orsakerna till genetiska förändringar i andra situationer oklara.
Symtom gliom i hjärnan
Funktioner hos fokal symtomatologi beror direkt på lokaliseringsområdet för hjärngliom och blir en konsekvens av alla typer av endokrina störningar, kompression av nervvävnad eller lokala destruktiva processer.
Om neoplasmen är belägen i parietalzonen, domineras en person av sådana manifestationer som anfall, sensoriska störningar, hörselnedsättning.
När gliomet är lokaliserat i området av den dominerande hemisfären upptäcks talstörningar, agrafi, agnosi.
Temporallobstumörer åtföljs ofta av konvulsiva anfall, afasi, nedsatt luktsinne och synförmåga samt dyspné.
När det intrakraniella trycket ökar utvecklas en motsvarande bild med begränsning av synfält, förlamning av ögonmusklerna och hemiplegi.
På grund av tumörprocessens specificitet åtföljs hjärngliom alltid av neurologiska symtom i större eller mindre utsträckning. Till en början finns det en märkbar allmän svaghet, patienten vill ständigt sova, arbetsförmågan försämras, tankeprocesserna saktas ner. Det är i detta skede som det finns en hög risk att ställa en felaktig diagnos och som en konsekvens förskriva fel behandling. Bland andra ospecifika manifestationer:
- Vestibulära störningar, inklusive ostadig gång, balansförlust (t.ex. vid cykling eller trappor), domningar i armar och ben, etc.;
- Gradvis försämring av synen, fördubbling av den visuella bilden;
- Försämring av hörselfunktionen;
- Suddrigt tal;
- Illamående och kräkningar i form av attacker oberoende av mat eller dryck;
- Försvagning av mimikmusklerna och andra ansiktsmuskler;
- Obehag vid sväljning;
- Regelbunden huvudvärk (ofta på morgontimmarna).
Den kliniska bilden expanderar gradvis och förvärras: hos vissa patienter sker det långsamt, hos andra - abrupt, bokstavligen "framför deras ögon", inom några veckor. I det senare fallet talar vi om ett aggressivt, snabbt utvecklande gliom i hjärnan.
Första tecken
Hjärngliom i de tidiga utvecklingsstadierna har inga uttalade symtom. De första manifestationerna misstas ofta för tecken på andra, mindre farliga patologier.
I allmänhet är den kliniska bilden av gliom varierande och bestäms av platsen och storleken på det patologiska fokuset. Allt eftersom tumören växer utvecklas och ökar allmänna cerebrala symtom:
- Ihållande och regelbunden huvudvärk som inte svarar på standardmediciner (icke-steroida antiinflammatoriska läkemedel);
- Intermittent illamående, ibland till och med kräkningar;
- En obekväm, tung känsla i ögonområdet;
- Kramper.
Cerebrala manifestationer är särskilt intensiva när tumören växer in i ventriklarna eller vätskesystemet. Dräneringen av cerebrospinalvätska försämras, det intrakraniella trycket ökar och hydrocefalus utvecklas. Processen påverkar en viss del av hjärnan, vilket påverkar utvecklingen av motsvarande klinik:
- Det finns problem med synfunktionen;
- Talnedsättning;
- Vestibulära störningar (yrsel, nedsatt koordination av rörelser) uppstår;
- Pares, förlamning av armar, ben;
- Minne och koncentrationsförmåga försämras;
- Tankeprocesser är försämrade;
- Beteendestörningar framträder.
I det inledande skedet är symtomen praktiskt taget frånvarande, eller så obetydliga att de inte väcker uppmärksamhet. Det är av denna anledning som experter starkt rekommenderar regelbundna förebyggande undersökningar och kontroller. Ju tidigare tumörprocessen upptäcks, desto större är chanserna till bot och överlevnad. [ 5 ]
Hjärngliom hos ett barn
Bland de många hjärntumörer som upptäcks i barndomen varierar andelen gliom från 15 till 25 %. Barn kan få sjukdomen i tidiga tonåren och början av tjugoårsåldern, även om det är mycket sällsynt att spädbarn under 3 år får sjukdomen.
Patologin börjar mot bakgrund av mutation i gliaceller. Hittills finns det inget svar på frågan om varför denna mutation uppstår.
Det enda som man tillförlitligt har lärt sig är att vissa ärftliga sjukdomar som är förknippade med en ökad risk för tumörtillväxt också ökar sannolikheten för att utveckla hjärngliom.
Dessutom har forskare upptäckt att gliaceller kan ha divergens i enskilda gener eller kromosomer. På grund av denna sjukdom aktiveras en mutationsmekanism som inte är ärftlig. Det är möjligt att detta inträffar i ett av de tidigaste utvecklingsstadierna.
Det är ett bevisat faktum att förekomsten av akut leukemi eller retinoblastom i barnets historia, eller hjärnbestrålning av någon annan anledning, avsevärt ökar riskerna för gliombildning (efter en viss tidsperiod).
Symtomatologi i barndomen beror på graden av malignitet och lokaliseringen av det patologiska fokuset. Man skiljer mellan specifika och ospecifika symtom:
- Ospecifika symtom är inte "kopplade" till det område där gliomet sitter. Vanliga manifestationer kan inkludera huvudvärk, yrsel, dålig aptit, kräkningar utan samband med matintag, viktminskning (av okänd anledning), konstant känsla av trötthet, minskade akademiska prestationer, koncentrationssvårigheter, beteendestörningar. Dessa tecken beror på kompression av intrakraniella strukturer, vilket kan förklaras som ett direkt tryck från den växande massan, och en störning i cirkulationen av cerebrospinalvätska. Det finns risk för cerebral hydrocele.
- Den specifika symtomatologin beror på den omedelbara platsen för glialpatologiskt fokus. Till exempel åtföljs en cerebellär tumör vanligtvis av nedsatt gång och balans hos barn. Skadan i den stora hjärnan manifesteras av konvulsiva anfall och tumörtillväxt i ryggmärgen - förlamning av muskulaturen. Det händer att barnets syn försämras kraftigt, medvetandet störs, sömnen försämras eller att något annat utvecklingsproblem uppstår.
Som regel uppenbarar sig malignt gliom i barndomen inom några veckor eller månader av dess utveckling: ofta kännetecknat av snabb och okontrollerad tillväxt av neoplasmen.
Barn med maligna glialtumörer behandlas av läkare på pediatriska kliniska centra som specialiserar sig på pediatrisk onkologi. Som regel används kirurgisk behandling, strålbehandling och kemoterapi.
Det viktigaste behandlingssteget är neurokirurgi. Ju mer radikal den är, desto bättre är barnets chanser att bli botad. Men kirurgiskt ingrepp är inte alltid möjligt: i synnerhet kan problem uppstå vid borttagning av hjärnstamsgliom, såväl som vid strålbehandling för barn under 3 år.
Gliom i centrala hjärnan (intermediat och midbrain) är svåra att avlägsna helt, eftersom det finns risk för skador på frisk vävnad. Om fullständig resektion av tumören är omöjlig ordineras patienten palliativ behandling.
Barn med maligna gliom behandlas enligt standardiserade protokoll som har fastställts genom rigoröst kontrollerade kliniska prövningar. De vanligaste protokollen är följande:
- HIT HGG 2007: omfattar behandling av barn i åldrarna 3-17 år.
- HIT SKK: lämplig för spädbarn (upp till tre år) och involverar inte strålbehandling.
Överlevnadsstatistiken för gliom hos barn är generellt sett inte särskilt optimistisk. Det är dock aldrig möjligt att i förväg förutsäga effektiviteten av behandlingsåtgärder för ett visst barn. Det är viktigt att noggrant följa alla läkares ordinationer, vilket avsevärt ökar chanserna till återhämtning.
Formulär
Gliom kan vara lågmaligna och högmaligna, med intensiv tillväxt och en benägenhet att metastasera. Det är viktigt att förstå att låg malignitet inte är synonymt med tumörsäkerhet. Varje hjärntumör skapar ytterligare volym, klämmer ihop hjärnstrukturer, vilket leder till deras förskjutning och ökat intrakraniellt tryck. Som ett resultat kan patienten dö.
Det finns två huvudtyper av maligna astrocytom. Dessa är glioblastom och anaplastiska astrocytom, vilka delas in efter molekylära förändringar. Sekundära maligna tumörer som utvecklats från astrocytom och har en låg grad av malignitet finns oftast hos unga patienter. Initialt maligna tumörer av glialtyp förekommer oftare hos äldre patienter.
Beroende på den strukturella platsen förekommer gliom i:
- Supratentoriell (med lokalisering ovanför lillhjärnan i området för laterala ventriklar, stora hemisfärer);
- Subtentoriell (med lokalisering nedanför lillhjärnan i den bakre kranialgropen).
Enligt histologiska egenskaper, särskilj sådana typer av gliom:
- Astrocytiskt gliom är det vanligaste. Det delas i sin tur in i nodulärt och diffust (det senare kan kännetecknas av snabb tillväxt och ett strokemönster).
- Oligodendrogliom - förekommer hos 5% av patienterna. Det har petrificater - områden med förkalkning, oftast i frontalloben.
- Ependymalt gliom - växer från strukturerna som kantar väggarna i ryggmärgens centrala kanal och kamrarna. Växer ofta in i hjärnans substans tjocklek, såväl som in i hjärnans lumen.
Blandade patologiska härdar såsom subependymom, oligoastrocytom etc. är också möjliga.
Alla gliom kategoriseras i följande stadier:
- Långsamt växande relativt godartade tumörer utan uppenbara kliniska symtom.
- Långsamt växande "borderline" gliom som gradvis övergår till stadium III och därefter.
- Malignt gliom.
- Malignt gliom med intensiv aggressiv tillväxt och spridning, med dålig prognos.
Ju lägre malignitetsstadium, desto mindre sannolikhet för metastasering och återfall av den borttagna tumören, och desto större är chanserna att patienten botar. Den största faran utgör glioblastom multiforme, en lågdifferentierad process med intensiv tillväxt och utveckling. [ 6 ]
Möjliga och vanligaste varianter av neurogliom:
- Gliom med lesioner i hjärnstammen och pontinregionen är lokaliserat i det område där hjärnan ansluter till ryggmärgen. Det är där viktiga neurocentra som ansvarar för andnings-, hjärt- och motorikfunktion är lokaliserade. Om denna zon är skadad störs vestibulär- och talapparatens arbete. Det upptäcks ofta i barndomen.
- Visuellt gliom drabbar neurogliaceller som omger synnerven. Patologin orsakar synnedsättning och exoftalmos. Det utvecklas oftare hos barn.
- Lågmalignt neurogliom kännetecknas av långsam tillväxt, oftare lokaliserat i de stora hemisfärerna och lillhjärnan. Det förekommer oftare hos unga personer (ungdomar och unga vuxna runt 20 år).
- Gliom i corpus callosum är mer karakteristiskt för individer mellan 40 och 60 år och representeras oftast av glioblastom.
- Chiasmagliom är lokaliserat i den optiska förbindelsezonen, så det åtföljs av myopi, synfältsförlust, ocklusiv hydrocefalus och neuroendokrina störningar. Det kan förekomma i alla åldrar, men drabbar oftast patienter med neurofibromatos typ I.
Komplikationer och konsekvenser
Gliom med låg malignitet (grad I-II, högmalignitet - t.ex. astrocytom, oligoastrocytom, oligodendrogliom, pleomorft xantoastrocytom, etc.) och hög malignitet (grad III-IV - glioblastom, anaplastiskt oligodendrogliom, oligoastrocytom och astrocytom). Grad IV-gliom är särskilt maligna.
Hjärnstamsgliom har en mycket ogynnsam prognos just för att tumören påverkar en sådan hjärnregion, där de viktigaste nervförbindelserna mellan hjärnan och extremiteterna är koncentrerade. Även en ganska liten tumör i detta område är tillräcklig för att patientens tillstånd snabbt försämras och framkalla förlamning.
Inte mindre ogynnsamma konsekvenser uppstår när andra hjärnregioner påverkas. Ofta är det en tumör i hjärnbarken, vilket inte ger patienten en chans till en lång livslängd, trots behandling. Det är ofta bara möjligt att skjuta upp döden.
Enligt medicinsk statistik är femårsöverlevnaden ofta bara 10–20 %. Även om dessa siffror till stor del beror på både graden av malignitet och den exakta lokaliseringen och omfattningen av det kirurgiska ingrepp som utförs. Efter fullständigt avlägsnande av det patologiska fokuset ökar överlevnaden avsevärt (ibland – upp till 50 %). Brist på behandling eller dess omöjlighet (av en eller annan anledning) garanterar att patienten dör.
Majoriteten av lågmaligna gliatumörer kan infiltrera hjärnvävnad och malignisera under flera år.
Risken för gliomåterfall anses av experter vara "mycket sannolik". Behandling bör dock inte försummas: det är viktigt att säkerställa en god livskvalitet så länge som möjligt.
Recidiverande gliom har alltid en sämre prognos än primära tumörer. Moderna behandlingsprotokoll baserade på terapeutiska optimeringsstudier uppnår dock ofta tillräckligt goda resultat för patienter även med mycket maligna tumörer.
Möjliga resultat efter kemoterapi:
- Avmagring, utmärgling, matsmältningsstörningar, orala sjukdomar;
- Ökad excitabilitet i centrala nervsystemet, asteni;
- Försämrad hörselfunktion, tinnitus och ringningar i öronen;
- Kramper, depressiva störningar;
- Hypertensiv kris, förändring i blodomloppet;
- Njursvikt;
- Allergiska processer, håravfall, utseende av pigmentfläckar på kroppen.
Efter kemoterapi noterar patienter en uttalad försvagning av immunförsvaret, vilket kan orsaka utveckling av olika infektiösa patologier.
Diagnostik gliom i hjärnan
Ett hjärngliom kan misstänkas genom följande tecken:
- Patienten har lokaliserade eller generaliserade kramper, vilka är karakteristiska för tumörens kortikala lokalisering och dess långsamma utveckling. Epi-kramper förekommer hos 80 % av patienter med låggradiga glialtumörer och hos 30 % av patienter med höggradiga gliom.
- Ökat intrakraniellt tryck är särskilt karakteristiskt för massor belägna i höger frontallob och parietallob. I samband med högt intrakraniellt tryck medför störningar i blodcirkulationen och vätskecirkulationen uppkomsten av konstant och ökande huvudvärk, illamående med kräkningar, synstörningar och dåsighet. Det finns ödem i synnerven, förlamning av den avledande nerven. En ökning av det intrakraniella trycket till kritiska värden kan leda till utveckling av koma och död. En annan orsak till högt intraokulärt tryck är hydrocefalus.
- Patienten har en växande fokal bild. I supratentoriska formationer störs de motoriska och sensoriska sfärerna, hemiopi, afasi och kognitiva störningar fortskrider.
Om läkaren misstänker förekomsten av en hjärntumör är det optimalt att utföra MR utan eller med kontrastmedel (gadolinium) för att fastställa dess placering, storlek och ytterligare egenskaper. Om magnetisk resonanstomografi inte är möjlig utförs datortomografi, och magnetisk resonansspektroskopi används som differentieringsmetod. Trots dessa diagnostiska metoders informativa egenskaper ställs den slutliga diagnosen först efter histologisk bekräftelse under resektion av tumörfokus.
Med tanke på ovanstående kriterier rekommenderas att diagnosen inleds med en grundlig anamnes, bedömning av somato-neurologisk status och funktionell status. Neurologisk status bedöms tillsammans med bestämning av sannolika intellektuella och mentala störningar.
Rekommenderade laboratorietester:
- En fullständig allmän klinisk blodundersökning;
- En fullständig blodkemipanel;
- Urinanalys;
- Blodkoagulationsstudie;
- Analys för onkologiska markörer (AFP, beta-hCG, LDH – relevant vid misstanke om lesion i tallkottkörteln).
För att klargöra prognostiska punkter hos patienter med glioblastom och anaplastiskt astrocytom utvärderas IDH1|2-1-genmutationen och MGMT-genmetyleringen. Hos patienter med oligodendrogliom och oligoastrocytom bestäms 1p|19q-kodlering.
Instrumentell diagnostik representeras först och främst av obligatorisk magnetisk resonanstomografi av hjärnan (ibland - och ryggmärgen). MR utförs i tre projektioner med standard T1-2, FLAIR, T1-lägen med kontrast.
Vid behov utförs ultraljud av kärlnätet, funktionell magnetisk resonanstomografi av motor- och talsektionerna, samt angiografi, spektroskopi, MR-traktografi och perfusion.
Ytterligare undersökningar kan innefatta:
- Elektroencefalografi av hjärnan;
- Konsultationer med neurokirurg, onkolog, radiolog, ögonläkare, radiolog.
Differentiell diagnos
Differentialdiagnos utförs nödvändigtvis med icke-tumörpatologier - i synnerhet med blödning orsakad av arteriovenös eller arteriell missbildning, såväl som med pseudotumoriska demyeliniserande processer, inflammatoriska sjukdomar (toxoplasmos, hjärnabscess, etc.).
Dessutom differentieras det primära tumörfokuset och metastaser i centrala nervsystemet.
Med moderna magnetiska resonanstomografimetoder är det möjligt att utföra diagnostiska åtgärder tillräckligt noggrant för att fastställa ursprunget till det primära fokus i centrala nervsystemet. MR av hjärnan utförs med eller utan kontrastmedel, i T1, T2 FLAIR-läge - i tre projektioner, eller tunna skivor i axiell projektion (SPGR-läge). Dessa diagnostiska metoder gör det möjligt att noggrant bestämma tumörens lokalisering, storlek, strukturella egenskaper, dess samband med kärlnätverket och närliggande hjärnområden.
Dessutom kan datortomografi (med eller utan kontrastmedel), datortomografi (MR-angiografi), MR-traktografi, MR- eller datortomografiperfusion utföras som en del av differentialdiagnosen. CT/PET av hjärnan med metionin, kolin, tyrosin och andra aminosyror används vid behov.
Behandling gliom i hjärnan
Specifik behandling består av kirurgiska, kemoterapeutiska och strålbehandlingsåtgärder. Det är obligatoriskt, om möjligt, att utföra en fullständig resektion av tumörfokus, vilket möjliggör snabb symtomlindring och histologisk bekräftelse av diagnosen.
Bestrålning har en positiv effekt på att öka patienternas livslängd. En total dos på 58 till 60 Gy, uppdelad i individuella bestrålningsdoser på 1,8-2 Gy, administreras som standard. Tumören bestrålas lokalt, och dessutom fångas upp till 3 cm runt den. Strålbehandling är mer acceptabelt jämfört med brachyterapi. I vissa fall rekommenderas radiokirurgiska metoder, vilka består av bestrålning med gammakniv eller linjär gaspedal, samt neutroninfångande borbehandling.
Behovet av adjuvant kemoterapi är kontroversiellt. I vissa fall har nitrosureapreparat möjliggjort en ökning av patienters livslängd med upp till ett och ett halvt år, men vissa resultat av användningen av sådana kemopreparat har varit negativa. Idag används aktivt cytotoxiska medel, neoadjuvant behandling (före strålbehandling), kombinerade läkemedel, intraarteriell kemoterapi eller högdoskemoterapi med ytterligare stamcellstransplantation.
I allmänhet, för framgångsrik behandling av gliom, är en omfattande strategi mycket viktig, vars omfattning beror på platsen och graden av malignitet hos massan, dess storlek och patientens allmänna hälsa.
När det gäller gliom i hjärnstammen används kirurgiskt ingrepp sällan. Den huvudsakliga kontraindikationen för kirurgi är fokusområdet - i närheten av vitala delar. I vissa fall är det möjligt att avlägsna gliom i bålen med hjälp av mikrokirurgiska metoder, med preoperativ och postoperativ kemoterapi. Sådant ingrepp är mycket komplext och kräver speciella kvalifikationer från en neurokirurg.
Strålkirurgi och i synnerhet stereotaktisk kirurgi med exponering för höga joniserande doser är ganska effektiv. Användningen av en sådan teknik i tidiga stadier av tumörutveckling möjliggör ibland långvarig remission eller till och med fullständig botning av patienten.
Strålbehandling kombineras ofta med kemoterapi, vilket förbättrar effekten av interventioner och minskar strålbelastningen. Vid gliom är inte alla kemopreventiva medel terapeutiskt framgångsrika, så de förskrivs individuellt och ordinationerna justeras vid behov.
För att minska smärta och sänka intrakraniellt tryck, oavsett huvudbehandling, föreskrivs symptomatisk behandling - i synnerhet kortikosteroidläkemedel, smärtstillande medel, lugnande medel.
Mediciner
Kortikosteroidläkemedel påverkar svullnad och minskar svårighetsgraden av neurologiska symtom i flera dagar. På grund av flera biverkningar och ökad sannolikhet för negativa interaktioner med kemoterapiläkemedel används dock minimalt effektiva doser av steroider, och de sätts ut så snart som möjligt (t.ex. efter operation).
Antikonvulsiva medel används systematiskt som en sekundär förebyggande åtgärd hos patienter som redan har haft epileptiska anfall. Dessa läkemedel kan orsaka allvarliga biverkningar och även interagera med kemoterapiläkemedel.
Antikoagulantia är särskilt relevanta i det postoperativa skedet, eftersom riskerna för tromboflebitbildning vid gliom är ganska höga (upp till 25%).
God effekt förväntas av att ta antidepressiva och ångestdämpande läkemedel. Användning av metylfenidat 10–30 mg/dag i två doser gör det ofta möjligt att optimera kognitiva förmågor, förbättra livskvaliteten och bibehålla arbetsförmågan.
Neurologiskt misslyckande och tecken på hjärnödem (smärta i huvudet, medvetandestörningar) elimineras av kortikosteroidläkemedel - i synnerhet Prednisolon eller Dexametason. |
Schemat och doseringen av kortikosteroider väljs individuellt, med utgångspunkt i den lägsta effektiva dosen. Vid slutet av behandlingskuren sätts läkemedlen gradvis ut. |
Kortikosteroider tas tillsammans med magskyddande läkemedel - protonpumpblockerare eller H2- histaminblockerare. |
Diuretika (furosemid, mannitol) förskrivs vid kraftig svullnad och förskjutning av hjärnstrukturer, som ett komplement till kortikosteroidläkemedel. |
Vid konvulsiva anfall (inklusive anamnes) eller epileptiforma symtom på elektroencefalogram förskrivs dessutom antikonvulsiv behandling. Antikonvulsiva medel förskrivs inte i profylaktiskt syfte. |
Patienter med indikationer för kemoterapi rekommenderas att ta antikonvulsiva medel som inte påverkar leverenzymfunktionen. Läkemedel som föredras: Lamotrigin, Valproinsyra, Levetiracetam. Bör inte användas: Karbamazepin, Fenobarbital. |
Huvudvärk vid hjärngliom hanteras med kortikosteroidbehandling. |
I vissa fall av huvudvärk kan icke-steroida antiinflammatoriska läkemedel eller tramadol användas. |
Om patienten tar icke-steroida antiinflammatoriska läkemedel, avbryts de några dagar före operationen för att minimera risken för blödning under operationen. |
I utvalda smärtfall kan narkotiska smärtstillande medel – såsom fentanyl eller trimeperidin – rekommenderas. |
För att förhindra lungemboli från den tredje postoperativa dagen förskrivs administrering av lågmolekylära hepariner - i synnerhet Enoxaparinnatrium eller Nadroparinkalcium. |
Om patienten står på systematisk antikoagulantia eller antiaggregeringsbehandling, överförs hen till lågmolekylära hepariner senast en vecka före kirurgiskt ingrepp, med ytterligare utsättning dagen före operationen och återupptagande 24-48 timmar efter operationen. |
Om en patient med gliom har venös trombos i nedre extremiteterna utförs behandling med direkta antikoagulantia. Möjligheten att placera ett CAVA-filter är inte utesluten. |
Kemoterapi för maligna gliom i hjärnan
De grundläggande antitumörkemoterapiregimerna för gliom anses vara:
- Lomustin 100 mg/m² på dag ett, vinkristin 1,5 mg/m² på dag ett och åtta, prokarbazin 70 mg/m² från dag åtta till tjugoförsta, kurer var sjätte vecka.
- Lomustin 110 mg/m² var sjätte vecka.
- Temozolomid 5/23 150 till 200 mg/m² från dag ett till dag fem, var 28:e dag.
- Temozolomid som en del av kemoradioterapibehandling, 75 mg/m² varje dag som strålning ges.
- Temozolomid med cisplatin eller karboplatin (80 mg/m²) och temozolomid 150–200 mg/m² på dag 1 till 5 var fjärde vecka.
- Temozolomid 7/7 vid 100 mg/m² på dag 1-8 och 15-22 av kuren, med en upprepning var fjärde vecka.
- Bevacizumab 5 till 10 mg/kg på dag ett och femton, och irinotekan 200 mg/m² på dag ett och femton, upprepat var fjärde vecka.
- Bevacizumab 5 till 10 mg/kg på dag ett, femton och tjugonio, och lomustin 90 mg/m² på dag ett var sjätte vecka.
- Bevacizumab 5 till 10 mg/kg på dag ett och femton, lomustin 40 mg på dag ett, åtta, femton och tjugotvå, upprepat var sjätte vecka.
- Bevacizumab 5 till 10 mg/kg på dag ett och femton, upprepat var fjärde vecka.
Cytostatika hämmar i många fall framgångsrikt tillväxten av tumörceller, men visar inte selektivitet gentemot friska vävnader och organ. Därför har experter identifierat ett antal kontraindikationer där kemoterapi av gliom är omöjlig:
- Överdriven individuell känslighet för kemopreventiva medel;
- Dekompensation av hjärt-, njur-, leverfunktion;
- Nedsatt hematopoes i benmärgen;
- Problem med binjurarnas funktion.
Kemoterapi administreras med extrem försiktighet:
- Patienter med betydande hjärtrytmrubbningar;
- Med diabetes;
- Vid akuta virusinfektioner;
- Till äldre patienter;
- Patienter som lider av kronisk alkoholism (kronisk alkoholförgiftning).
Den allvarligaste biverkningen av kemopreventiva läkemedel är deras toxicitet: cytostatika påverkar selektivt blodcellernas funktion och förändrar deras sammansättning. Som en konsekvens minskar trombocyt- och erytrocytmassan och anemi utvecklas.
Innan en patient får en kemoterapikur, tar läkaren alltid hänsyn till läkemedlens toxicitet och de sannolika komplikationerna efter deras användning. Kemoterapikurer övervakas alltid noggrant av specialister och blodet kontrolleras regelbundet.
Möjliga konsekvenser av cytostatisk behandling:
- Magerhet, avmagring;
- Svårigheter att svälja mat, torra slemhinnor, parodontit, dyspepsi;
- Instabilitet i centrala nervsystemet, manodepressiva störningar, anfallssyndrom, asteni;
- Försämring av hörselfunktionen;
- Ökning av blodtrycket upp till utveckling av hypertensiv kris;
- Minskning av blodplättar, röda blodkroppar, vita blodkroppar, multipla blödningar, inre och yttre blödningar;
- Njursvikt;
- Allergiska processer;
- Håravfall, uppkomsten av områden med ökad pigmentering.
Efter kemoterapikurer har patienter en ökad risk att utveckla infektionssjukdomar, och muskel- och ledvärk är vanligt.
För att minska risken för negativa effekter efter kemoterapi krävs ytterligare rehabiliteringsåtgärder, vars syfte är att återställa normal blodbild, stabilisera kardiovaskulär aktivitet och normalisera neurologisk status. Tillräckligt psykologiskt stöd ges nödvändigtvis.
Kirurgisk behandling
Operationen utförs för att avlägsna tumörfokus så mycket som möjligt, vilket i sin tur bör minska det intrakraniella trycket, minska neurologisk insufficiens och tillhandahålla det nödvändiga biomaterialet för forskning.
- Operationen utförs på en specialiserad neurokirurgisk avdelning eller klinik vars specialister har erfarenhet av neuro-onkologiska ingrepp.
- Kirurgen utför åtkomst genom plastisk bentrepanation i området där gliom misstänks vara lokaliserat.
- Om tumören är anatomiskt belägen nära motoriska områden eller banor, eller i kärnorna eller längs kranialnerver, används intraoperativ neurofysiologisk övervakning.
- Neuronavigationssystem, intraoperativ fluorescensnavigering med 5-aminolevulensyra är önskvärt för att maximera avlägsnandet av neoplasmen.
- Efter ingreppet utförs en kontroll-CT eller MRI (med eller utan kontrastmedelsinjektion) dag 1-2.
Om kirurgisk resektion av gliom är omöjlig eller initialt erkänns som olämpligt, eller om lymfom i centrala nervsystemet misstänks, utförs en biopsi (öppen, stereotaktisk, med navigationsövervakning etc.). |
Patienter med cerebral gliomatos verifieras med stereotaktisk biopsi, eftersom terapeutisk taktik i hög grad beror på den histologiska bilden. |
I vissa situationer – hos äldre patienter, vid allvarliga neurologiska störningar, vid lokalisering av gliom i bålen och andra vitala delar – planeras behandlingen baserat på symtom och bildinformation efter en allmän medicinsk konsultation. |
Patienter med piloid astrocytom såväl som nodulära former av hjärnstamsneoplasmer och exofytiska processer rekommenderas att genomgå resektion eller öppen biopsi. |
Patienter med diffust pontingliom och andra diffusa neoplasmer i bålen behandlas med strålbehandling och antitumörmedicin. Verifiering är inte nödvändig i sådana fall. |
Patienter med tetraplegiskt plattgliom genomgår systematisk magnetresonansbehandling och klinisk övervakning efter att cerebral hydrocele har avlägsnats. Om tumören visar tecken på tillväxt avlägsnas den med ytterligare bestrålning. |
När partiell resektion eller biopsi av ett låggradigt malignt gliom utförs, behandlas patienter med två eller flera riskfaktorer nödvändigtvis med strålbehandling och/eller kemoterapi. |
Total resektion är obligatorisk för patienter med subependymalt jättecellsastrocytom. |
Everolimus förskrivs för diffust subependymalt jättecellsastrocytom. |
Piloid astrocytom bör avlägsnas med magnetisk resonanstomografi efter intervention för att klargöra kvaliteten på radikal resektion av tumörvävnad. |
Vid glioblastom bör postoperativ behandling kombineras (strålning + kemoterapi) med administrering av temozolomid. |
Vid anaplastiskt astrocytom efter operation är strålbehandling med ytterligare läkemedelsbehandling indicerad. Lomustin och temozolomid används. |
Patienter med anaplastiskt oligodendrogliom eller oligoastrocytom får både strålbehandling och kemoterapi (temozolomid eller PCV-monoterapi) efter operationen. |
Äldre patienter med omfattande högmalignt gliom bestrålas i hypofraktionerad mod, eller så utförs monoterapi med temozolomid. |
Vid gliomåterfall diskuteras möjligheten till reoperation och efterföljande behandlingstaktik av ett specialistkonsilium. Optimal behandling vid återfall: reoperation + systemisk kemoterapi + upprepad strålbehandling + palliativa åtgärder. Om det finns lokala mindre områden med återkommande tumörtillväxt kan strålkirurgi användas. |
De läkemedel som valts vid återkommande gliomtillväxt är temozolomid och bevacizumab. |
Återfall av högmaligna oligodendrogliom och anaplastiska astrocytom är en indikation för temozolomidbehandling. |
Pleomorft xanthoastrocytom avlägsnas utan obligatorisk adjuvant kemoterapi. |
En av särdragen hos gliom är svårigheten att behandla och avlägsna dem. Kirurgen strävar efter att avlägsna tumörvävnaderna så fullständigt som möjligt för att uppnå kompensation för tillståndet. Många patienter kan förbättra livskvaliteten och förlänga den, men för mycket maligna tumörer förblir prognosen ogynnsam: det finns en ökad sannolikhet för återväxt av det patologiska fokuset.
Näring för hjärngliom
Kost för patienter med maligna tumörer är en viktig punkt som många tyvärr inte ägnar så mycket uppmärksamhet åt. Samtidigt, tack vare förändringar i kosten, är det möjligt att bromsa utvecklingen av gliom och stärka ett nedsatt immunförsvar.
Viktiga områden för kostförändringar:
- Normalisering av metaboliska processer, stärkande av immunförsvaret;
- Avgiftning av kroppen;
- Optimering av energipotential;
- Att säkerställa normal funktion av alla organ och system i kroppen under en så svår period för dem.
Rationell och balanserad kost är nödvändig, både för patienter med tidiga stadier av lågmaligna tumörer och patienter med glioblastom i sista stadiet. Noggrant utvald kost bidrar till förbättring av det allmänna välbefinnandet och återhämtning av skadade vävnader, vilket är särskilt viktigt mot bakgrund av cytostatika och strålbehandling. Balansen mellan näringskomponenter och korrekta metaboliska processer förhindrar bildandet av infektionshärdar, blockerar inflammatoriska reaktioner och förhindrar utmattning av kroppen.
Följande livsmedel och drycker rekommenderas för hjärngliom:
- Röda, gula och orangefärgade frukter och grönsaker (tomater, persikor, aprikoser, morötter, rödbetor, citrusfrukter) som innehåller karotenoider, som skyddar friska celler från de negativa effekterna av strålbehandling;
- Kål (blomkål, broccoli, brysselkål), rädisa, senap och andra växtprodukter som innehåller indol - en aktiv substans som neutraliserar negativa toxiska och kemiska faktorer;
- Grönsaker (dill, persilja, unga maskros- och nässelblad, rabarber, ruccola, spenat), gröna ärtor och sparris, sparrisbönor och alger (tång, spirulina, chlorella);
- Grönt te;
- Vitlök, lök, ananas, som har antitumör- och avgiftningsförmåga;
- Kli, flingor, fullkornsbröd, grodda baljväxter, spannmål och frön;
- Mörka druvor, hallon, jordgubbar och jordgubbar, blåbär, björnbär, granatäpple, vinbär, svarta vinbär, rönnbär, havtorn, körsbär och andra bär som innehåller naturliga antioxidanter som minskar de negativa effekterna av fria radikaler, virus och cancerframkallande ämnen;
- Mjölkprodukter med låg fetthalt.
Du bör inte belasta matsmältningssystemet och hela kroppen med tung och fet mat. Det är bra att använda färskpressade hemlagade juicer, smoothies, snacks. Källor till omega-3-fettsyror, såsom fiskolja, linfröolja eller linfrön, bör tillsättas i rätterna.
Det är bättre att helt undvika socker och sötsaker. Men en sked honung med en kopp vatten skadar inte: biprodukter har en uttalad antiinflammatorisk, antioxidant och antitumörhämmande effekt. Den enda kontraindikationen för användning av honung är en allergi mot produkten.
Från kosten bör uteslutas:
- Kött, ister, slaktbiprodukter;
- Smör, feta mejeriprodukter;
- Rökt kött, korv, konserverat kött och fisk;
- Alkohol i någon form;
- Godis, bakverk, kakor och bakverk, godis och choklad;
- Färdigmat, snabbmat, snacks;
- Friterade livsmedel.
Du bör konsumera tillräckligt med grönsaker, grönsaker, frukt och rent dricksvatten dagligen.
Under cellgiftsbehandlingen och en tid efteråt bör du dricka hemgjorda grönsaks- och fruktjuicer, äta hemlagad mager keso, mjölk och ost. Det är viktigt att dricka mycket vätska, borsta tänderna och skölja munnen ofta (cirka 4 gånger om dagen).
Optimala måltider för patienter med hjärngliom:
- Grönsaksgrytor;
- Tillbehör och soppor gjorda av spannmål (helst bovete, havregryn, ris, couscous, bulgur);
- Ångkokta cheesecakes, puddingar, grytor;
- Kokade och bakade grönsaker;
- Grytor, grönsakssoppor, för- och efterrätter från baljväxter (inklusive soja), patéer och suffléer;
- Smoothies, grönt te, kompott och tilltugg.
Förebyggande
Om en person lever en hälsosam livsstil, och bland hans släktingar fanns inga fall av cancerpatologi, har han all chans att inte få hjärngliom. Det finns inget specifikt förebyggande av sådana tumörer, så de viktigaste förebyggande punkterna anses vara korrekt kost, fysisk aktivitet, undvikande av dåliga vanor, frånvaro av yrkes- och hushållsrisker.
Specialister ger ett antal enkla men effektiva rekommendationer:
- Drick mer rent vatten, undvik sötad läsk, förpackade juicer, energidrycker och alkohol.
- Undvik yrkes- och hushållsrisker: mindre kontakt med kemikalier, frätande lösningar och vätskor.
- Försök att tillaga mat genom att koka, sjuda, baka, men inte steka. Föredra hälsosam, hemlagad mat av hög kvalitet.
- En stor del av din kost bör bestå av växtbaserade livsmedel, inklusive grönsaker, oavsett årstid.
- En annan negativ faktor är övervikt, vilket man bör bli av med. Viktkontroll är mycket viktigt för hela kroppens hälsa.
- Vegetabiliska oljor bör alltid föredras framför smör och ister.
- Om möjligt är det önskvärt att prioritera miljövänliga produkter, kött utan hormoner, grönsaker och frukter utan nitrater och bekämpningsmedel. Det är bättre att undvika rött kött helt och hållet.
- Ta inte multivitaminpreparat utan indikationer och i stora mängder. Ta inga läkemedel utan läkares recept: självmedicinering är ofta mycket, mycket farligt.
- Om misstänkta symtom uppstår är det nödvändigt att besöka en läkare utan att vänta på att situationen förvärras, att biverkningar och komplikationer utvecklas.
- Sötsaker och livsmedel med högt glykemiskt index är en oönskad del av kosten.
- Ju tidigare en person går till läkaren, desto bättre är chanserna att bli frisk (och detta gäller nästan alla sjukdomar, inklusive hjärngliom).
För att förhindra bildandet av onkopatologi behöver du tillräckligt med tid för att sova och vila, undvika överdriven konsumtion av alkoholhaltiga drycker, föredra högkvalitativ naturlig mat, minska användningen av prylar (särskilt mobiltelefoner).
Tumörsjukdomar förekommer ofta hos äldre och gamla människor. Därför är det viktigt att övervaka sin egen hälsa från ung ålder och att inte provocera fram patologiska processer genom ohälsosam livsstil och ohälsosamma vanor.
De exakta orsakerna till onkologi har ännu inte klarlagts. Men ogynnsamma yrkes- och miljöförhållanden, exponering för joniserande och elektromagnetisk strålning samt hormonella förändringar spelar naturligtvis en viss roll. Stanna inte länge och regelbundet i solen, tillåt inte plötsliga förändringar i omgivningstemperaturen, överhetta dig i badet eller bastun, ta ofta varma bad eller duschar.
En annan fråga: hur kan man förhindra återfall av hjärngliom efter framgångsrik behandling? Återfall av tumörtillväxt är en komplex och tyvärr frekvent komplikation, som är svår att förutsäga i förväg. Patienter kan rekommenderas att genomgå regelbundna förebyggande undersökningar och kontroller, besöka en onkolog och behandlande läkare minst två gånger om året, leva en hälsosam livsstil, äta hälsosam och naturlig mat, utöva måttlig fysisk aktivitet. Ett annat villkor är livsglädje, sund optimism, positiv inställning till framgång under alla omständigheter. Detta inkluderar också en vänlig atmosfär i familjen och på jobbet, tålamod och ovillkorligt stöd från nära och kära.
Prognos
Hjärnans tillstånd och gliomets egenskaper vid tidpunkten för upptäckten påverkar överlevnadsgraden lika mycket som den administrerade behandlingen. En tillfredsställande allmän hälsa hos patienten och dennes ålder förbättrar prognosen (prognosen är mer optimistisk hos unga patienter). En viktig indikator är den histologiska bilden av tumören. Således har låggradiga gliom en bättre prognos än anaplastiska gliom och, i ännu högre grad, glioblastom (de mest ogynnsamma tumörprocesserna). Astrocytom har en sämre prognos än oligodendrogliom.
Maligna astrocytom svarar dåligt på behandling och har en relativt låg överlevnadsgrad på sex till fem år. Samtidigt uppskattas den förväntade livslängden för låggradiga gliom till 1–10 år.
Maligna astrocytom är i princip obotliga. Behandlingsinriktningen innebär vanligtvis att minska neurologiska manifestationer (inklusive kognitiv dysfunktion) och öka livslängden samtidigt som högsta möjliga livskvalitet bibehålls. Symtomatisk behandling föredras mot bakgrund av rehabiliteringsåtgärder. En psykologs arbete är också viktigt.
Under det senaste decenniet har forskare gjort vissa framsteg när det gäller att förstå hjärntumörers natur och hur man behandlar dem. Mycket mer bör göras för att optimera prognosen för sjukdomen. Dagens specialisters primära uppgift är följande: hjärngliom bör ha flera system för effektiv eliminering av problemet samtidigt, både i tidiga och senare utvecklingsstadier.

