Medicinsk expert av artikeln
Nya publikationer
Patogenesen av hepatit B
Senast recenserade: 07.07.2025

Allt iLive-innehåll är mediekontrollerat eller faktiskt kontrollerat för att säkerställa så mycket faktuell noggrannhet som möjligt.
Vi har strikta sourcing riktlinjer och endast länk till välrenommerade media webbplatser, akademiska forskningsinstitut och, när det är möjligt, medicinsk peer granskad studier. Observera att siffrorna inom parentes ([1], [2] etc.) är klickbara länkar till dessa studier.
Om du anser att något av vårt innehåll är felaktigt, omodernt eller på annat sätt tveksamt, välj det och tryck på Ctrl + Enter.
I patogenesen av hepatit B kan flera ledande länkar i den patogenetiska kedjan identifieras:
- introduktion av patogenen - infektion;
- fixering på hepatocyten och penetration in i cellen;
- multiplikation av viruset och dess "uttryckning" på hepatocytens yta, såväl som in i blodet;
- aktivering av immunologiska reaktioner som syftar till att eliminera patogenen;
- immunkomplexskador på organ och system;
- bildande av immunitet, frisättning från patogenen, återhämtning.
Eftersom infektion med hepatit B alltid sker parenteralt kan man anse att infektionstidpunkten praktiskt taget är likvärdig med virusets penetration i blodet. Vissa forskares försök att skilja enterala och regionala faser vid hepatit B är dåligt underbyggda. Det finns fler skäl att tro att viruset omedelbart kommer in i levern med blodflödet.
Hepatit B-virusets tropism till levervävnad förutbestäms av närvaron av en speciell receptor i HBsAg - en polypeptid med en molekylvikt på 31 000 Da (P31), som har albuminbindande aktivitet. En liknande albuminzon finns också på membranet hos hepatocyter i levern hos människor och schimpanser, vilket i huvudsak bestämmer HBV:s tropism till levern hos människor och schimpanser.
När viruset penetrerar hepatocyten frigörs viralt DNA, vilket, genom att komma in i hepatocytkärnan och fungera som en matris för syntesen av nukleinsyror, utlöser en serie sekventiella biologiska reaktioner, vars resultat är sammansättningen av virusets nukleokapsid. Nukleokapsiden migrerar genom kärnmembranet in i cytoplasman, där den slutliga sammansättningen av Dane-partiklar - det kompletta hepatit B-viruset - sker.
Det bör dock noteras att när en hepatocyt infekteras kan processen ske på två sätt - replikativt och integrativt. I det första fallet utvecklas en bild av akut eller kronisk hepatit, och i det andra - virusbärande.
Orsakerna bakom de två typerna av interaktion mellan viralt DNA och hepatocyter har inte exakt fastställts. Troligtvis är typen av respons genetiskt bestämd.
Resultatet av replikativ interaktion är sammansättningen av kärnantigenstrukturerna (i kärnan) och sammansättningen av det kompletta viruset (i cytoplasman), följt av presentationen av det kompletta viruset eller dess antigener på membranet eller i hepatocytmembranets struktur.
Det är allmänt accepterat att virusreplikation inte leder till cellskador på hepatocytnivå, eftersom hepatit B-viruset inte har någon cytopatisk effekt. Denna ståndpunkt kan inte anses obestridlig, eftersom den är baserad på experimentella data som, även om de indikerar avsaknaden av en cytopatisk effekt av hepatit B-viruset, erhölls på vävnadskulturer och därför inte helt kan extrapoleras till viral hepatit B hos människor. I vilket fall som helst kräver frågan om avsaknaden av hepatocytskada under replikationsfasen ytterligare studier.
Oavsett arten av virusets interaktion med cellen är levern nödvändigtvis inkluderad i den immunopatologiska processen. I detta fall är skadorna på hepatocyter förknippade med det faktum att som ett resultat av uttrycket av virala antigener på hepatocytmembranet och frisättningen av virala antigener i fri cirkulation, ingår en kedja av sekventiella cellulära och humorala immunreaktioner, som i slutändan syftar till att avlägsna viruset från kroppen. Denna process utförs i full överensstämmelse med de allmänna mönstren för immunsvaret mot virusinfektioner. För att eliminera patogenen ingår cellulära cytotoxiska reaktioner, medierade av olika klasser av effektorceller: K-celler, T-celler, naturliga mördare, makrofager. Under dessa reaktioner förstörs de infekterade hepatocyterna, vilket åtföljs av frisättningen av virala antigener (HBcAg, HBeAg, HBsAg), som utlöser antikroppsgenessystemet, vilket resulterar i att specifika antikroppar ackumuleras i blodet, främst mot kärnan - anti-HBc och e-antigen - anti-HBE. Följaktligen sker frisättningen av levercellen från viruset i processen för dess död på grund av reaktionerna av cellulär cytolys.
Samtidigt binder specifika antikroppar som ackumuleras i blodet virusantigenerna och bildar immunkomplex som fagocyteras av makrofager och utsöndras av njurarna. I detta fall kan olika immunkomplexskador uppstå i form av glomerulonefrit, arterit, artralgi, hudutslag etc. Med deltagande av specifika antikroppar renas kroppen från patogenen och fullständig återhämtning sker.
I enlighet med det skisserade konceptet för patogenesen av hepatit B förklaras vanligtvis all mångfald av kliniska varianter av sjukdomsförloppet av virusets särdrag i interaktionen med immunkompetenta cellers samarbete, med andra ord, styrkan i immunsvaret på närvaron av virala antigener. Enligt moderna koncept är immunsvarets styrka genetiskt bestämd och kopplad till histokompatibilitetsantigenerna hos HLA-locus av den första klassen.
Det är allmänt accepterat att under förhållanden med ett adekvat immunsvar mot virusantigener utvecklas akut hepatit kliniskt med ett cykliskt förlopp och fullständig återhämtning. Mot bakgrund av en minskning av immunsvaret mot virusantigener uttrycks immunmedierad cytolys obetydligt, därför sker ingen effektiv eliminering av infekterade leverceller, vilket leder till milda kliniska manifestationer med långvarig persistens av viruset och eventuellt utveckling av kronisk hepatit. Samtidigt, tvärtom, vid ett genetiskt bestämt starkt immunsvar och massiv infektion (hemotransfusion), uppstår omfattande områden med levercellsskador, vilket kliniskt motsvarar svåra och maligna former av sjukdomen.
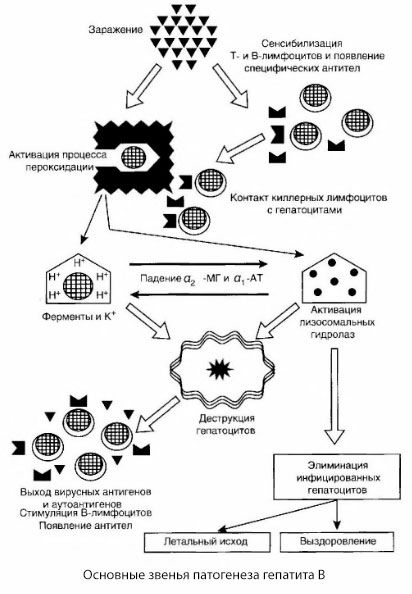
Det presenterade schemat för patogenesen av hepatit B kännetecknas av dess koherens; det innehåller dock ett antal kontroversiella och dåligt studerade punkter.
Om vi följer konceptet hepatit B som en immunopatologisk sjukdom, kan vi förvänta oss en ökning av cellulära cytotoxiska reaktioner med ökande svårighetsgrad av sjukdomen. I svåra former minskar dock indexen för den cellulära immunitetslänken kraftigt, inklusive en multipel minskning, jämfört med de hos friska barn, och K-cells cytotoxicitetsindexet. I den maligna formen, under utvecklingen av massiv levernekros och särskilt leverkoma, noteras en fullständig oförmåga hos lymfocyterna att spränga transformationen under inverkan av fytohemattlutinin, stafylokockendotoxin och HBsAg. Dessutom saknas leukocyternas förmåga att migrera enligt leukocytmigrationsinhiberingsreaktionen (LMIC), och en kraftig ökning av permeabiliteten hos lymfocytmembranen avslöjas enligt resultaten av deras studier med en fluorescerande tetracyklinprob.
Om fluorescensindexen för lymfocyter hos friska personer är 9,9 ± 2 %, och vid typisk hepatit B med godartat förlopp ökar de till 22,3 ± 2,7 %, når antalet fluorescerande lymfocyter i genomsnitt 63,5 ± 5,8 %. Eftersom en ökning av cellmembranens permeabilitet i litteraturen entydigt bedöms som en tillförlitlig indikator på deras funktionella underlägsenhet, kan man dra slutsatsen att vid hepatit B, särskilt i den maligna formen, finns det grov skada på lymfocyterna. Detta bevisas också av indexen för K-cells cytotoxicitet. I en svår form, under den 1-2:a veckan av sjukdomen, är cytotoxiciteten 15,5 ± 8,8 %, och i den maligna formen under den 1:a veckan - 6,0 ± 2,6, under den 2:a - 22,0 ± 6,3 % med en norm på 44,8 ± 2,6 %.
De presenterade uppgifterna indikerar tydligt uttalade störningar i den cellulära länken till immunitet hos patienter med svåra former av hepatit B. Det är också uppenbart att dessa förändringar sker sekundärt, som ett resultat av skador på immunkompetenta celler av toxiska metaboliter och eventuellt cirkulerande immunkomplex.
Som studier har visat, minskar titern av HBsAg och HBeAg i blodserum hos patienter med svåra former av hepatit B, särskilt vid utveckling av massiv levernekros, och samtidigt börjar antikroppar mot ytantigenet detekteras i höga titrar, vilket är helt okarakteristiskt för godartade former av sjukdomen, där anti-HBV endast uppträder under 3:e-5:e månaden av sjukdomen.
Det snabba försvinnandet av hepatit B-virusantigener med samtidig uppkomst av höga titrar av antivirala antikroppar tyder på intensiv bildning av immunkomplex och deras möjliga deltagande i patogenesen för utvecklingen av massiv levernekros.
Således tillåter inte faktamaterialet oss att entydigt tolka hepatit B endast utifrån immunopatologisk aggression. Och poängen är inte bara att inget samband finns mellan djupet och förekomsten av morfologiska förändringar i levern, å ena sidan, och svårighetsgraden av cellulära immunitetsfaktorer, å andra sidan. Teoretiskt sett skulle denna omständighet kunna förklaras av de sena stadierna av studien av cellulära immunitetsindikatorer, då immunkompetenta celler utsattes för kraftfulla toxiska effekter på grund av ökande funktionell insufficiens i levern. Naturligtvis kan man anta att immuncytolys av hepatocyter sker i de tidigaste stadierna av den infektiösa processen, möjligen redan innan kliniska symtom på allvarlig leverskada uppstår. Ett sådant antagande är dock osannolikt, eftersom liknande indikatorer på cellulär immunitet upptäcktes hos patienter med det mest akuta (blixtnedslag) förloppet av sjukdomen och dessutom upptäcktes inte massiv lymfocytisk infiltration under morfologisk undersökning av levervävnad, samtidigt som kontinuerliga fält av nekrotiskt epitel upptäcktes utan fenomenet resorption och lymfocytisk aggression.
Det är mycket svårt att förklara den morfologiska bilden av akut hepatit enbart utifrån immuncellulär cytolys, därför uteslöts inte den cytotoxiska effekten av hepatit B-viruset i tidiga studier.
För närvarande har detta antagande delvis bekräftats genom upptäckten av hepatit B-viruset. Som studier har visat är frekvensen av detektion av hepatit D-markörer direkt beroende av sjukdomens svårighetsgrad: i milda former detekteras de hos 14 %, måttliga - hos 18 %, svåra - 30 % och maligna - hos 52 % av patienterna. Med tanke på att hepatit D-viruset har en nekrosogen cytopatisk effekt kan det anses vara fastställt att samtidig infektion med hepatit B- och D-virus är av stor betydelse för utvecklingen av fulminanta former av hepatit B.
Patogenesen för hepatit B kan presenteras enligt följande. Efter att hepatit B-viruset har penetrerat hepatocyterna induceras en immunologisk attack på de infekterade hepatocyterna av T-mördare, som utsöndrar lymfotoxiner i riktning mot levercellerna.
De intima mekanismerna för leverskador vid hepatit B har ännu inte fastställts. Den ledande rollen spelas av aktiverade processer för lipidperoxidation och lysosomala hydrolaser. Utlösande faktorn kan vara lymfotoxiner som frigörs från effektorceller vid deras kontakt med hepatocyter, men det är möjligt att viruset självt kan vara initiatorn av peroxidationsprocesser. Därefter utvecklas den patologiska processen troligtvis i följande sekvens.
- Interaktion mellan aggressionsfaktorn (lymfotoxiner eller virus) och biologiska makromolekyler (möjligen med komponenter i endoplasmatiska retikulummembranen som kan delta i avgiftningsprocesser, analogt med andra skadliga ämnen, vilket visats i samband med koltetraklorid).
- Bildning av fria radikaler, aktivering av lipidperoxidationsprocesser och ökad permeabilitet hos alla hepatocellulära membran (cytolyssyndrom).
- Förflyttning av biologiskt aktiva substanser längs koncentrationsgradienten - förlust av enzymer med olika intracellulära lokaliseringar, energidonatorer, kalium, etc. Ackumulering av natrium och kalcium i celler, pH-förskjutning mot intracellulär acidos.
- Aktivering och frisättning av lysosomala hydrolaser (RNAse, DNAse, katepsiner, etc.) med nedbrytning av leverceller och frisättning av autoantigener.
- Stimulering av T- och B-immunsystemen med bildandet av specifik sensibilisering av T-lymfocyter mot leverlipoprotein, samt bildandet av antihepatiska humorala autoantikroppar.
I det föreslagna schemat för hepatit B-patogenes är den utlösande faktorn virala antigener, vars intensiva produktion observeras i de tidigaste stadierna av sjukdomen och under hela den akuta perioden, med undantag för maligna former, där produktionen av virala antigener praktiskt taget upphör vid tidpunkten för utveckling av massiv levernekros, vilket förutbestämmer en snabb minskning av virusreplikation.
Det är också uppenbart att virala antigener aktiverar immunitetens T- och B-system. Under denna process sker en karakteristisk omfördelning av T-lymfocyt-subpopulationer, som syftar till att organisera ett adekvat immunsvar, eliminera infekterade hepatocyter, neutralisera virala antigener, sanogenes och återhämtning.
När immunkompetenta celler interagerar med virala antigener på hepatocytmembran eller under virusreproduktion inuti en hepatocyt, uppstår förhållanden för aktivering av lipidperoxidationsprocesser, vilka, som bekant, kontrollerar permeabiliteten hos alla cellulära och subcellulära membran.
Från denna position blir förekomsten av cytolyssyndrom, en ökad permeabilitet av cellmembran, vilket är så naturligt och mycket karakteristiskt för viral hepatit, förståelig.
Det slutliga resultatet av cytolyssyndrom kan vara fullständig frikoppling av oxidativ fosforylering, läckage av cellulärt material och död av leverparenkymet.
I de allra flesta fall utvecklas dock dessa processer inte så dödligt. Endast vid maligna former av sjukdomen fortskrider den patologiska processen lavinartat och irreversibelt, eftersom massiv infektion, en uttalad immunprocess, överdriven aktivering av peroxidationsprocesser och lysosomala hydrodaser samt autoimmuna aggressionsfenomen uppstår.
Samma mekanismer observeras vid gynnsamt förlopp av hepatit B, med den enda egenheten att de alla realiseras på en kvalitativt olika nivå. Till skillnad från fall av massiv levernekros är antalet infekterade hepatocyter, och därmed zonen för immunopatologisk cytolys, mindre vid gynnsamt sjukdomsförlopp, processerna för lipidperoxidation är inte lika signifikant förstärkta, aktiveringen av syrahydrolaser leder endast till begränsad autolys med en obetydlig frisättning av autoantigener, och därför, utan massiv autoaggression, det vill säga, alla stadier av patogenesen vid gynnsamt förlopp utförs inom ramen för den bevarade strukturella organisationen av leverparenkymet och begränsas av försvarssystem (antioxidanter, hämmare, etc.) och har därför inte en sådan destruktiv effekt.
Orsakerna till berusningssymtom vid viral hepatit har inte studerats fullt ut. Förslaget att skilja mellan så kallad primär, eller viral, berusning och sekundär (utbytes- eller metabolisk) berusning kan anses vara positivt, även om detta inte avslöjar den intima mekanismen för uppkomsten av generellt toxiskt syndrom. För det första har hepatitvirus inte toxiska egenskaper, och för det andra korrelerar koncentrationen av många metaboliter inte alltid med sjukdomens svårighetsgrad och graden av uttryck av toxicossymtom. Det är också känt att koncentrationen av virala antigener inte strikt korrelerar med berusningens svårighetsgrad. Tvärtom, med en ökning av sjukdomens svårighetsgrad, och därmed ökningen av graden av toxicos, minskar koncentrationen av HBsAg och är lägst i maligna former vid tidpunkten för uppkomsten av djup leverkoma. Samtidigt beror detektionsfrekvensen och titrarna av specifika antivirala antikroppar direkt på sjukdomens svårighetsgrad.
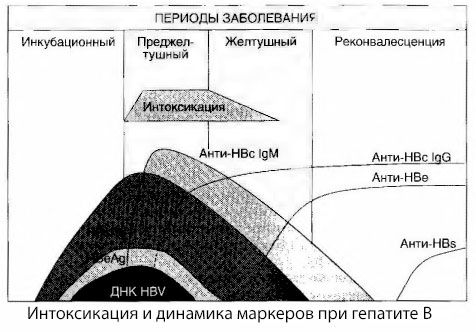
Intoxikation uppträder inte vid registrering av virala antigener, utan under cirkulationen i blodet av antivirala antikroppar av klass IgM mot ko-antigenet och antigenet i E-systemet. Dessutom, i svåra och särskilt maligna former, har en betydande andel patienter till och med anti-HB i blodet, vilket vanligtvis aldrig observeras i milda och måttliga former av sjukdomen.
De presenterade uppgifterna gör det möjligt att dra slutsatsen att toxicossyndromet vid viral hepatit, och hepatit B i synnerhet, inte uppstår som ett resultat av förekomsten av virala antigener i blodet, utan är en konsekvens av interaktionen mellan virala antigener och antivirala antikroppar av IgM-klassen. Resultatet av sådan interaktion är, som bekant, bildandet av immunkomplex och eventuellt aktiva toxiska substanser.
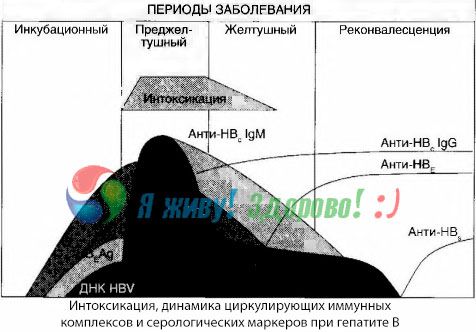
Symtom på berusning uppstår i samband med immunkomplexens uppkomst i fri cirkulation, men därefter observeras inte en sådan korrelation.
En delvis förklaring till detta kan hittas i studien av immunkomplexens sammansättning. Hos patienter med svåra former cirkulerar övervägande medelstora komplex i blodet, och i deras sammansättning, vid höjdpunkten av det toxiska syndromet, dominerar antikroppar av klassen, medan under perioden med nedgång i kliniska manifestationer och konvalescens blir komplexen större, och i deras sammansättning börjar antikroppar av IgG-klassen dominera.
De presenterade uppgifterna avser mekanismerna för utveckling av toxiskt syndrom under sjukdomens initiala period, men vid toxicos som uppstår vid höjdpunkten av kliniska manifestationer har de endast delvis betydelse, och särskilt vid utveckling av leverkoma.
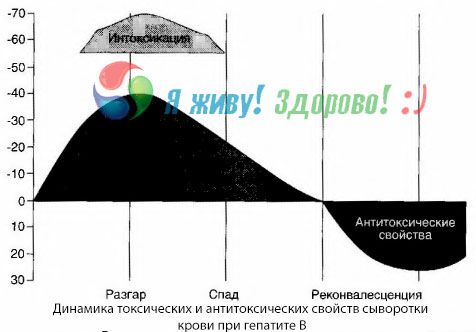
Blododlingsmetoden har visat att vid hepatit B ackumuleras gifter ständigt i blodet, frigjorda från den skadade, förfallna levervävnaden. Koncentrationen av dessa gifter är proportionell mot sjukdomens svårighetsgrad, de är av proteinkaraktär.
Under återhämtningsperioden uppträder antikroppar mot detta toxin i blodet; men vid leverkoma ökar koncentrationen av toxinet i blodet kraftigt, och antikroppar detekteras inte i blodet.
Patomorfologi för hepatit B
Baserat på arten av morfologiska förändringar skiljer sig tre former av akut hepatit B:
- cyklisk form,
- massiv levernekros;
- kolestatisk perikolangiolytisk hepatit.
Vid den cykliska formen av hepatit B är dystrofiska, inflammatoriska och proliferativa förändringar mer uttalade i lobulernas centrum, medan de vid hepatit A är lokaliserade längs lobulens periferi och sprider sig till centrum. Dessa skillnader förklaras av olika vägar för viruspenetration in i leverparenkymet. Hepatit A-viruset kommer in i levern genom portvenen och sprider sig till lobulernas centrum, medan hepatit B-viruset penetrerar genom leverartären och kapillärgrenarna som jämnt försörjer alla lobuler, ända upp till deras centrum.
Graden av skada på leverparenkymet motsvarar i de flesta fall svårighetsgraden av sjukdomens kliniska manifestationer. I milda former observeras vanligtvis fokal nekros av hepatocyter, och i måttliga och svåra former - zonal nekros (med en tendens att slås samman och bilda broliknande nekros i svåra former av sjukdomen).
De största morfologiska förändringarna i parenkymet observeras vid höjdpunkten av kliniska manifestationer, vilket vanligtvis sammanfaller med sjukdomens första decennium. Under det andra och särskilt det tredje decenniet intensifieras regenereringsprocesserna. Vid denna period försvinner nekrobiotiska förändringar nästan helt och cellulära infiltrationsprocesser börjar dominera med långsam efterföljande återställning av strukturen hos de hepatocellulära plattorna. Fullständig återställning av leverparenkymets struktur och funktion sker dock först 3-6 månader efter sjukdomsdebut och inte hos alla patienter.
Infektionens generaliserade natur vid hepatit B bekräftas genom att HBsAg detekteras inte bara i hepatocyter, utan även i njurar, lungor, mjälte, bukspottkörtel, benmärgsceller etc.
Kolestatisk (perikolangiolytisk) hepatit är en speciell form av sjukdomen, där de största morfologiska förändringarna finns i de intrahepatiska gallgångarna, med en bild av kolangiolit och perikolangiolit. Vid den kolestatiska formen uppstår kolestas med utvidgning av gallkapillärerna med gallstasis i dem, med proliferation av kolangioler och cellulära infiltrat runt dem. Levercellerna påverkas obetydligt vid denna form av hepatit. Kliniskt kännetecknas sjukdomen av ett utdraget förlopp med långvarig gulsot. Det har visats att orsaken till ett sådant säreget sjukdomsförlopp är virusets dominerande effekt på kolangiolens väggar med en obetydlig effekt på hepatocyter.

