Humant immunbristvirus (HIV)
Last reviewed: 01.06.2018

Vi har strikta riktlinjer för sourcing och länkar endast till välrenommerade medicinska webbplatser, akademiska forskningsinstitutioner och, när det är möjligt, medicinskt granskade studier. Observera att siffrorna inom parentes ([1], [2] etc.) är klickbara länkar till dessa studier.
Om du anser att något av vårt innehåll är felaktigt, föråldrat eller på annat sätt tveksamt, vänligen markera det och tryck på Ctrl + Enter.
Förvärvat immunbristsyndrom identifierades som en specifik sjukdom 1981 i USA, då ett antal unga människor utvecklade allvarliga sjukdomar orsakade av mikroorganismer som var icke-patogena eller svagt patogena för friska personer. En studie av patienternas immunstatus visade en kraftig minskning av antalet lymfocyter i allmänhet och T-hjälpare i synnerhet. Detta tillstånd kallades AIDS (förvärvat immunbristsyndrom). Smittvägen (sexuell kontakt, genom blod och dess preparat) indikerade sjukdomens infektiösa natur.
Sjukdomsmedlet bakom AIDS upptäcktes 1983 oberoende av fransmannen L. Montagnier, som kallade det LAV Lymfoadenopatiassocierat virus, eftersom han hittade det hos en patient med lymfadenopati; och amerikanen R. Gallo, som kallade viruset HTLV-III (humant T-lymfotropiskt virus III): han hade tidigare upptäckt lymfotropa virus I och II.
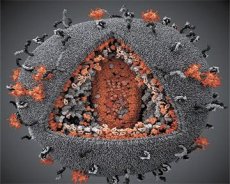
En jämförelse av egenskaperna hos LAV- och HTLV-III-virusen visade deras identitet, så för att undvika förvirring fick viruset namnet HIV (Humant Immunbristvirus, eller HIV) år 1986. HIV har en sfärisk form med en diameter på 110 nm. Virushöljet har formen av en polyeder, bestående av 12 pentagoner och 20 hexagoner. I mitten och hörnen av varje hexagon finns en molekyl av glykosylerat protein gpl20 (siffran 120 anger proteinets molekylvikt i kilodalton). Totalt 72 gpl20-molekyler är belägna på virionens yta i form av speciella spikar, som var och en är associerad med det intramembrana proteinet gp41. Dessa proteiner, tillsammans med det dubbla lipidskiktet, bildar virionens superkapsid (membran).
Proteinerna gpl20 och gp41 bildas genom att Env-prekursorproteinet klyvs av ett cellulärt proteas. Gp41-proteinet bildar spik-"stammen" genom att binda med sin cytoplasmatiska domän till matrisproteinet p17MA som ligger direkt under höljet. p17-molekylerna interagerar under virionmognaden för att bilda en ikosaeder som ligger under höljet.
I virionens centrala del bildar p24-proteinet en konformad kapsid. Den avsmalnade delen av kapsiden är kopplad till virionmembranet med deltagande av rb-proteinet. Inuti kapsiden finns två identiska molekyler av viralt genomiskt RNA. De är kopplade med sina 5'-ändar till nukleokapsidproteinet p7NC. Detta protein är intressant eftersom det har två aminosyrarester (motiv) rika på cystein och histidin och innehållande en Zn-atom - de kallas "zinkfingrar" eftersom de fångar upp molekyler av genomiskt RNA för inkludering i de bildande virionerna. Kapsiden innehåller också tre enzymer. Revertas (RT), eller pol-komplex, inkluderar omvänt transkriptas, RNase H och DNA-beroende DNA-polymeras. Revertas finns som en heterodimer p66/p51. Proteas (PR) - p10, initierar och implementerar processen för virionmognad. Integras (IN) - p31, eller endonukleas, säkerställer att proviralt DNA inkluderas i värdcellens genom. Kapsiden innehåller också en molekyl av primer-RNA (tRNAl"3).
RNA-genomet i cellen omvandlas till ett DNA-genom (DNA-provirus) med hjälp av omvänt transkriptas, bestående av 9283 nukleotidpar. Det begränsas till vänster och höger av så kallade långa terminala upprepningar, eller LTR:er: S'-LTR till vänster och 3'-LTR till höger. LTR innehåller 638 nukleotidpar vardera.
HIV-genomet består av 9 gener, av vilka några överlappar varandra i ändarna (har flera läsramar) och har en exonintronstruktur. De styr syntesen av 9 strukturella och 6 regulatoriska proteiner.
Betydelsen av LTR:er för virusgenomet är att de innehåller följande reglerande element som styr dess funktion:
- transkriptionssignal (promotorregion);
- poly-A-additionssignal;
- överkappningssignal;
- integrationssignal;
- positiv regleringssignal (TAR för TAT-protein);
- negativt reglerande element (NRE för NEF-protein);
- ett fästställe för primer-RNA (tRNA™3) för minus-strängs-DNA-syntes vid 3'-änden; en signal vid 5'-änden av LTR som fungerar som en primer för plus-strängs-DNA-syntes.
Dessutom innehåller LTR element involverade i regleringen av mRNA-splitsning, paketering av vRNA-molekyler i kapsiden (Psi-element). Slutligen, under genomtranskriptionen, bildas två signaler i långa mRNA för REV-proteinet, vilka växlar proteinsyntes: CAR - för regulatoriska proteiner och CRS - för strukturella proteiner. Om REV-proteinet binder till CAR syntetiseras strukturella proteiner; om det saknas syntetiseras endast regulatoriska proteiner.
Följande regulatoriska gener och deras proteiner spelar en särskilt viktig roll för att reglera virusgenomets funktion:
- TAT-protein, som utför positiv kontroll av virusreplikation och verkar genom TAR-regleringsregionen;
- NEV- och VPU-proteiner, vilka utövar negativ kontroll över replikationen genom NRE-regionen;
- REV-protein, som utför positiv-negativ kontroll. REV-proteinet kontrollerar arbetet hos gag-, pol- och env-gener och utför negativ reglering av splitsning.
Således är HIV-replikation under trippel kontroll - positiv, negativ och positiv-negativ.
VIF-proteinet bestämmer det nysyntetiserade virusets infektionsförmåga. Det är associerat med p24-kapsidproteinet och finns i virionen i en mängd av 60 molekyler. NEF-proteinet representeras i virionen av ett litet antal molekyler (5-10), eventuellt associerade med höljet.
VPR-proteinet hämmar cellcykeln i G2-fasen, deltar i transporten av preintegrationskomplex in i cellkärnan, aktiverar vissa virala och cellulära gener och ökar effektiviteten av virusreplikeringen i monocyter och makrofager. Platsen för VPR-, TAT-, REV- och VPU-proteinerna i virionet har inte fastställts.
Förutom sina egna proteiner kan virionmembranet innehålla vissa proteiner från värdcellen. VPU- och VPR-proteinerna deltar i regleringen av viral reproduktion.
Antigena varianter av humant immunbristvirus (HIV)
Humant immunbristvirus (HIV) är mycket variabelt. Även från en patients kropp kan virusstammar isoleras som skiljer sig avsevärt i antigena egenskaper. Sådan variation underlättas av den intensiva destruktionen av CD4+ celler och ett kraftfullt antikroppssvar mot HIV-infektion. En ny form av HIV, HIV-2, biologiskt nära HIV-1 men immunologiskt olik den, har isolerats från patienter från Västafrika. Homologin hos den primära strukturen hos dessa virusgenom är 42 %. DNA-proviruset HIV-2 innehåller 9671 bp och dess LTR - 854 bp. HIV-2 isolerades senare i andra regioner i världen. Det finns ingen korsimmunitet mellan HIV-1 och HIV-2. Två stora former av HIV-1 är kända: O (Outlier) och M (Major), den senare är uppdelad i 10 subtyper (AJ). Åtta subtyper (AH) cirkulerar i Ryssland.
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
Mekanismen för HIV:s interaktion med cellen
Efter att viruset har penetrerat kroppen attackerar det först celler som innehåller den CD4-receptor som är specifik för det. Denna receptor finns i stora mängder i T-hjälpare, i mindre mängder i makrofager och monocyter, och T-hjälpare är särskilt känsliga för viruset.
Humant immunbristvirus (HIV) känner igen CD4-receptorer med hjälp av sitt gpl20-protein. HIV:s interaktion med cellen sker enligt följande schema: receptormedierad adsorption -> belagd grop -> belagd vesikel -> lysosom. I den sammansmälter virionmembranet med lysosommembranet, och nukleokapsiden, som frigjorts från superkapsiden, kommer in i cytoplasman; på väg till kärnan förstörs den, och genomiskt RNA och tillhörande kärnkomponenter frigörs. Därefter syntetiserar omvänt transkriptas minussträngen av DNA på virion-RNA:t, sedan förstör RNase H virion-RNA:t, och viralt DNA-polymeras syntetiserar plussträngen av DNA. 5'-LTR och 3'-LTR bildas i ändarna av DNA-proviruset. DNA-proviruset kan stanna kvar i kärnan under en tid i inaktiv form, men förr eller senare integreras det i målcellens kromosom med hjälp av dess integras. I det förblir proviruset inaktivt tills den givna T-lymfocyten aktiveras av mikrobiella antigener eller andra immunkompetenta celler. Aktivering av cellulär DNA-transkription regleras av en speciell nukleär faktor (NF-kB). Det är ett DNA-bindande protein och produceras i stora mängder under aktivering och proliferation av T-lymfocyter och monocyter. Detta protein binder till vissa sekvenser av cellulärt DNA och liknande LTR-sekvenser av DNA-proviruset och inducerar transkription av både cellulärt DNA och DNA-provirus. Genom att inducera transkription av DNA-proviruset genomför det övergången av viruset från ett inaktivt tillstånd till ett aktivt och följaktligen från en ihållande infektion till en produktiv. Proviruset kan förbli i ett inaktivt tillstånd under mycket lång tid. Aktivering av viruset är ett kritiskt ögonblick i dess interaktion med cellen.
Från det ögonblick viruset penetrerar cellen börjar perioden med HIV-infektion - virusbärartillståndet, vilket kan vara i 10 år eller mer; och från det ögonblick viruset aktiveras börjar sjukdomen - AIDS. Med hjälp av dess regulatoriska gener och deras produkter börjar viruset aktivt reproducera sig. TAT-proteinet kan öka virusets reproduktionshastighet med 1000 gånger. Viral transkription är komplex. Den inkluderar bildandet av både fullängds- och subgenomiskt mRNA, mRNA-splitsning, och sedan sker syntesen av strukturella och regulatoriska proteiner.
Syntesen av strukturella proteiner sker enligt följande. Först syntetiseras Pr55Gag-prekursorpolyproteinet (ett protein med en molekylvikt på 55 kDa). Det innehåller fyra huvuddomäner: matrix (MA), kapsid (CA), nukleokapsid (NC) och rb-domänen, från vilken, som ett resultat av att Pr55Gag klyvs av viralt proteas (det självklyvs från ett annat prekursorprotein, Gag-Pol), bildas de strukturella proteinerna p17, p24, p7 respektive rb. Bildningen av Pr55Gag-polyproteinet är huvudvillkoret för bildandet av virala partiklar. Det är detta protein som bestämmer virionens morfogenes-program. Det inkluderar sekventiellt transportstegen av Gag-polyproteinet till plasmamembranet, interaktion med det och protein-protein-interaktioner under bildandet av viralpartikeln och dess knoppning. Pr55Gag syntetiseras på fria polyribosomer; proteinmolekyler transporteras till membranet, där de förankras av sina hydrofoba regioner. CA-domänen spelar huvudrollen i att skapa den nativa konformationen av Gag-proteinet. NC-domänen säkerställer att två molekyler genomiskt RNA inkluderas (med hjälp av sina "zinkfingrar") i den bildande viruspartikelns sammansättning. Polyproteinmolekylen dimeriseras initialt på grund av interaktionen mellan matrisdomänerna. Sedan kombineras dimererna till hexameriska (6 enheter) komplex som ett resultat av interaktionen mellan CA- och NC-domänerna. Slutligen bildar hexamererna, som förenas vid sina laterala ytor, omogna sfäriska virioner, inuti vilka det genomiska virala RNA:t finns, fångat av NC-domänen.
Ett annat prekursorprotein, Prl60Gag-Pol (ett protein med en molekylvikt på 160 kDa), syntetiseras som ett resultat av en läsramsförskjutning av ribosomen under translation av 3'-änden av gag-genen i regionen som är belägen omedelbart uppströms om regionen som kodar för rb-proteinet. Detta Gag-Pol-polyprotein innehåller en ofullständig Gag-proteinsekvens (1-423 aminosyror) och Pol-sekvenser som inkluderar PR-, RT- och IN-domänerna. Gag-Pol-polyproteinmolekyler syntetiseras också på fria polyribosomer och transporteras till plasmamembranet. Prl60Gagpol-polyproteinet innehåller alla intermolekylära interaktionsställen och membranbindningsställen som är inneboende i Gag-polyproteinet. Därför smälter Gag-Pol-polyproteinmolekylerna samman med membranet och inkluderas tillsammans med Gag-molekylerna i de bildande virionerna, vilket resulterar i uppkomsten av aktivt proteas och början av virionmognadsprocessen. HIV-1-proteaset är endast mycket aktivt i form av en dimer, därför krävs dimerisering av dessa molekyler för att kunna brytas bort från Prl60Gag-Pol. Virionmognad består av att det frisatta aktiva proteaset klipper prl60Gag-Pol och Gag55 på de ställen det känner igen; proteinerna p17, p24, p7, p6, revertas och integras bildas och de associeras med virusstrukturen.
Env-proteinet syntetiseras på ribosomer associerade med membranen i det endoplasmatiska retikulum, glykosyleras sedan, klyvs av ett cellulärt proteas till gp120 och gp41 och transporteras till cellytan. I detta fall penetrerar gp41 membranet och binder till matrisdomänerna i Gag-proteinmolekylen associerad med membranets inre yta. Denna koppling bevaras i det mogna virionet.
Således består sammansättningen av viruspartiklar av aggregering av prekursorproteiner och associerade RNA-molekyler på värdcellens plasmamembran, bildandet av omogna virioner och deras frisättning genom knoppning från cellytan. Under knoppningen omger sig virionet med ett cellmembran i vilket gp41- och gp120-molekylerna är inbäddade. Under knoppningen eller, eventuellt, efter frisättningen av virioner sker deras mognad, vilket utförs med hjälp av ett viralt proteas och består av proteolytisk klyvning av prekursorproteinerna Pr55Gag och Prl60Gag-Pol till proteiner i det mogna viruset och deras association till vissa strukturella komplex. Den ledande rollen i processerna för viral morfogenes spelas av prekursorpolyproteinet Pr55Gag, som organiserar och sätter ihop det omogna virionet; dess mognadsprocessen fullbordas av ett specifikt viralt proteas.
Orsaker till immunbrist
En av de främsta orsakerna till immunbrist vid HIV-infektion är massdöden av T-hjälpare. Det sker som ett resultat av följande händelser. För det första dör T-hjälpare infekterade med viruset på grund av apoptos. Man tror att hos AIDS-patienter är virusreplikation, apoptos och en minskning av antalet T-hjälpare sammankopplade. För det andra känner T-mördare igen och förstör T-celler som är infekterade med viruset eller bär adsorberade gpl20-molekyler, såväl som virusinfekterade och icke-virusinfekterade T-hjälpare, som bildar symplaster (syncytium) bestående av flera dussin celler (vissa av dem dör som ett resultat av virusreproduktion i dem). Som ett resultat av förstörelsen av ett stort antal T-hjälpare sker en minskning av uttrycket av membranreceptorer i B-lymfocyter till interleukin-2, syntesen av olika interleukiner (tillväxtfaktorer och differentiering av B-lymfocyter - IL-4, IL-5, IL-6, etc.) störs, vilket resulterar i en störning av T-mördarsystemets funktion. Aktiviteten i komplement- och makrofagsystemen hämmas. Makrofager och monocyter infekterade med viruset dör inte under lång tid, men de kan inte avlägsna viruset från kroppen. Slutligen, på grund av den strukturella och antigena likheten mellan gpl20 och receptorerna i vissa epitelceller i kroppen (inklusive trofoblastreceptorer som medierar transplantationsöverföringen av HIV), syntetiseras antireceptorantikroppar med ett brett verkningsspektrum. Sådana antikroppar kan blockera olika cellulära receptorer och komplicera sjukdomsförloppet med autoimmuna sjukdomar. Konsekvensen av HIV-infektion är att alla huvudlänkar i immunsystemet sviktar. Sådana patienter blir försvarslösa mot en mängd olika mikroorganismer. Detta leder till utveckling av opportunistiska infektioner och tumörer. För patienter med HIV-infektion ökar risken att utveckla minst tre typer av cancer: Kaposis sarkom; karcinom (inklusive hudcancer); B-cellslymfom, som uppstår på grund av malign transformation av B-lymfocyter. HIV är dock inte bara lymfocytotropiskt, utan också neurotropiskt. Det penetrerar cellerna i det centrala nervsystemet (astrocyter) både genom receptormedierad endocytos och genom fagocytos av virusinfekterade lymfoblaster av astrocyter. När viruset interagerar med astrocyter bildas också symplaster, vilket underlättar spridningen av patogenen genom intercellulära kanaler. Viruset kan finnas kvar i makrofager och monocyter under lång tid, så de fungerar som en reservoar och distributör av det i kroppen och kan penetrera alla vävnader. Infekterade makrofager spelar en viktig roll i införandet av HIV i det centrala nervsystemet och dess skador. Hos 10% av patienterna är primära kliniska syndrom associerade med skador på det centrala nervsystemet och manifesterar sig som demens. Således kännetecknas personer infekterade med HIV av 3 grupper av sjukdomar - opportunistiska infektioner,tumörsjukdomar och skador på centrala nervsystemet.
Epidemiologi för HIV-infektion
Källan till HIV-infektion är endast en person - en sjuk person eller en virusbärare. Humant immunbristvirus (HIV) finns i blod, spermier, livmoderhalsvätska; hos ammande mödrar - i bröstmjölk. Infektion sker sexuellt, genom blod och dess preparat, samt från mor till barn före, under och efter förlossningen. Fall av infektion med viruset genom mat, dryck och insektsbett är inte kända.
Drogberoende bidrar till spridningen av AIDS. Förekomsten av HIV ökar varje år. Enligt WHO var 58 miljoner människor smittade med HIV från 1980 till 2000. Bara under 2000 var 5,3 miljoner människor smittade världen över, och 3 miljoner människor dog av AIDS. Den 1 januari 2004 registrerades 264 tusen HIV-infekterade personer i Ryssland. Hälften av de HIV-infekterade dör inom 11–12 år från smittoögonblicket. I början av 2004 levde cirka 180 av varje 100 000 medborgare i Ryssland med diagnosen "HIV-infektion". Det förutspås att med denna sjuklighetsnivå kommer det totala antalet HIV-infekterade personer i Ryssland år 2012 att vara 2,5–3 miljoner människor. Komplexiteten i kampen mot HIV-infektion beror på ett antal skäl: för det första finns det inga effektiva metoder för dess behandling och specifikt förebyggande; för det andra kan inkubationstiden för HIV-infektion överstiga 10 år. Dess varaktighet beror på aktiveringsögonblicket för T-lymfocyten och DNA-proviruset som finns i dess kromosom. Det är fortfarande oklart om alla som är infekterade med viruset är dömda till AIDS eller om långvarig bärare av viruset utan sjukdom är möjlig (vilket verkar osannolikt). Slutligen finns det flera humana immunbristvirus (HIV-1, HIV-2), vars antigena skillnader förhindrar bildandet av korsimmunitet. Upptäckten av simian immunbristvirus (SIV) belyste frågan om HIV:s ursprung. SIV liknar HIV i sin genomorganisation, men skiljer sig avsevärt i sin nukleotidsekvens. HIV-2 intar en mellanliggande position mellan HIV-1 och SIV i sina serologiska egenskaper och är närmare SIV i sin nukleotidsekvens. I detta avseende föreslog V.M. Zhdanov att HIV-1-, HIV-2- och SIV-virus härstammar från en gemensam förfader. Det är möjligt, enligt R. Gallo, att en av SIV:erna på något sätt har kommit in i människokroppen, där den genomgick en serie mutationer, vilket resulterade i uppkomsten av HIV-1, HIV-2 och dess andra former.
Symtom på HIV-infektion
Humant immunbristvirus har vissa egenskaper som i hög grad avgör sjukdomens patogenes. Viruset har en mycket hög reproduktionshastighet, bestämd av dess regulatoriska element (upp till 5 000 virioner syntetiseras på 5 minuter i aktivt stadium). På grund av närvaron av fusionsproteinet (gp41) inducerar viruset bildandet av omfattande syncytialstrukturer på grund av fusion av infekterade och oinfekterade T-hjälpare, vilket resulterar i deras massdöd. De gpl20-proteinmolekyler som bildas i stora mängder cirkulerar fritt i blodet och binder till receptorerna hos oinfekterade T-hjälpare, vilket resulterar i att de också känns igen och förstörs av T-mördare. Viruset kan spridas genom intercellulära kanaler från cell till cell, i vilket fall det blir svårtillgängligt för antikroppar.
Kliniska kriterier för HIV-infektion
Hos vuxna diagnostiseras HIV-infektion när de har minst två allvarliga symtom i kombination med minst ett lindrigt symtom och i frånvaro av andra kända orsaker till immunbrist (cancer, medfödd immunbrist, svår svält etc.). Allvarliga symtom inkluderar:
- viktminskning på 10 % eller mer;
- ett långvarigt febertillstånd, intermittent eller konstant;
- kronisk diarré.
Lindriga symtom: ihållande hosta, generaliserad dermatit, återkommande herpes zoster, oral och faryngeal candidiasis, kronisk herpes simplex, generaliserad lymfadenopati. Diagnosen AIDS ställs endast vid förekomst av Kaposis sarkom, kryptokockmeningit, pneumocystisk lunginflammation. Den kliniska bilden av sjukdomen påverkas av den åtföljande opportunistiska infektionen.
Metoder för odling av humant immunbristvirus (HIV)
HIV-1 och HIV-2 kan odlas i celler från endast en klon av TCV4-lymfocyter - H9, erhållen från leukemiska TCV4-lymfocyter. Monolagerkulturer av astrocytceller, där HIV-1 reproducerar sig väl, kan också användas för dessa ändamål. Schimpanser är mottagliga för HIV-1 bland djur.
Virusets resistens i den yttre miljön är låg. Det dör under påverkan av solljus och UV-strålning, förstörs vid 80 °C inom 30 minuter, vid behandling med vanligt förekommande desinfektionsmedel - inom 20-30 minuter. För att desinficera virusinnehållande material är det nödvändigt att använda mykobakteriedödande desinfektionsmedel, eftersom de är effektiva mot mikroorganismer med högst resistens.
Laboratoriediagnostik av HIV-infektion
Den huvudsakliga metoden för att diagnostisera virusbärande och HIV-infektion är enzymimmunoanalys. Men på grund av att gpl20 har strukturell och antigenlikhet med receptorer i vissa mänskliga celler, inklusive receptorer som transporterar immunoglobuliner genom epitelceller i slemhinnorna, kan antikroppar relaterade till antikroppar mot gpl20 förekomma i kroppen. I detta fall kan det förekomma falskt positiva ELISA-resultat. Därför genomgår alla positivt reagerande sera från försökspersonerna ytterligare analys med hjälp av immunoblottingmetoden, eller Western blotting. Denna metod är baserad på identifiering av de antikroppar som studeras efter deras elektroforetiska separation och efterföljande testning med hjälp av märkta antikroppar mot arten. Den virologiska metoden används sällan på grund av komplexiteten i att odla viruset. H9-lymfocytklonen används för att erhålla virala antigener - de nödvändiga komponenterna i diagnostiska testsystem. CPR-metoden möjliggör detektion av viruset i ett tidigt skede av viremi.
Behandling av HIV-infektion
Det är nödvändigt att hitta eller syntetisera läkemedel som effektivt hämmar aktiviteten hos omvänt transkriptas (revertas) eller viralt proteas. De skulle förhindra bildandet av DNA-provirus och (eller) hämma intracellulär reproduktion av viruset. Den moderna strategin för behandling av HIV-infekterade patienter bygger på principen om kombinerad användning av läkemedel som hämmar viralt proteas (ett av läkemedlen) och revertas (två olika läkemedel) - kombinerad (trippel) terapi. I Ryssland rekommenderas kombinerad användning av två inhemska läkemedel för behandling av HIV-infekterade patienter: fosfazid och crixivan, som specifikt hämmar HIV-reproduktion i tidiga och sena reproduktionsstadier, särskilt med minskad aktivitet av azidotymidin.
Problemet med specifik profylax är behovet av att skapa ett vaccin som säkerställer bildandet av effektiv cellmedierad immunitet baserad på virusspecifika cytotoxiska lymfocyter utan någon signifikant produktion av antikroppar. Sådan immunitet tillhandahålls av Thl-hjälpare. Det är möjligt att antikroppar, inklusive virusneutraliserande, inte bara är ineffektiva för att undertrycka HIV-infektion, utan att de i hög grad undertrycker cellmedierad immunitet. Därför måste ett anti-HIV-vaccin först och främst uppfylla två huvudkrav: a) vara absolut säkert och b) stimulera aktiviteten hos T-cytotoxiska lymfocyter. Effektiviteten hos olika vaccinvarianter erhållna från dödade (inaktiverade) virus och från individuella antigener med höga skyddande egenskaper studeras. Sådana antigener kan antingen isoleras från själva virionerna eller syntetiseras kemiskt. Ett vaccin skapat baserat på gentekniska metoder har föreslagits. Det är ett rekombinant vacciniavirus som bär HIV-gener som är ansvariga för syntesen av antigener med starka immunogena egenskaper. Frågan om effektiviteten hos dessa vacciner kräver avsevärd tid på grund av den långa inkubationstiden för HIV-infektion och patogenens höga variation. Skapandet av ett mycket effektivt vaccin mot HIV är ett brådskande grundläggande problem.
