Medicinsk expert av artikeln
Nya publikationer
Behandling av svår sepsis och septisk chock
Senast recenserade: 04.07.2025

Allt iLive-innehåll är mediekontrollerat eller faktiskt kontrollerat för att säkerställa så mycket faktuell noggrannhet som möjligt.
Vi har strikta sourcing riktlinjer och endast länk till välrenommerade media webbplatser, akademiska forskningsinstitut och, när det är möjligt, medicinsk peer granskad studier. Observera att siffrorna inom parentes ([1], [2] etc.) är klickbara länkar till dessa studier.
Om du anser att något av vårt innehåll är felaktigt, omodernt eller på annat sätt tveksamt, välj det och tryck på Ctrl + Enter.
Effektiv behandling av sepsis är endast möjlig med fullständig kirurgisk sanering av infektionsområdet och adekvat antimikrobiell behandling. Otillräcklig initial antimikrobiell behandling är en riskfaktor för dödsfall hos patienter med sepsis. Att bevara patientens liv, förebygga och eliminera organdysfunktioner är endast möjligt med riktad intensivvård.
Dess huvudmål är att optimera syrgastransporten under förhållanden med ökad konsumtion, vilket är typiskt för svår sepsis och septisk chock. Denna behandling genomförs genom hemodynamiskt och andningsstöd.
Hemodynamiskt stöd
Infusionsbehandling
Infusionsbehandling är en av de första åtgärderna för att upprätthålla hemodynamiken och framför allt hjärtminutvolymen. Dess huvudsakliga uppgifter hos patienter med sepsis är:
- återställande av tillräcklig vävnadsperfusion,
- korrigering av homeostasrubbningar,
- normalisering av cellmetabolism,
- minskning av koncentrationen av septiska kaskadmediatorer och toxiska metaboliter.
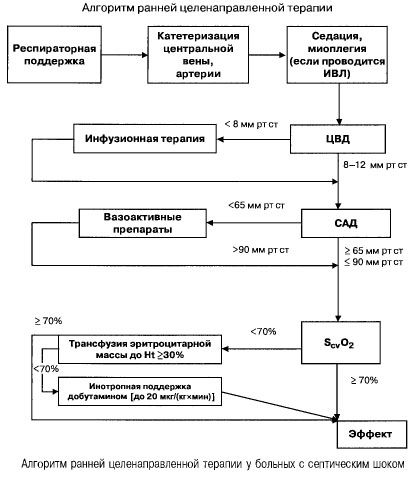
Vid sepsis med multipel organsvikt och septisk chock försöker man snabbt (inom de första 6 timmarna) uppnå följande värden för viktiga indikatorer:
- hematokrit >30%,
- diures 0,5 ml/(kg/h),
- blodmättnad i vena cava superior eller höger förmak >70%,
- medelblodtryck >65 mm Hg,
- CVP 8–12 mm Hg
Att bibehålla dessa värden på den angivna nivån förbättrar patientens överlevnad (evidenskategori B). Hemodynamisk övervakning med Swan-Ganz-kateter och PICCO-teknik (transpulmonell termodilution och pulsvågsanalys) utökar möjligheterna att övervaka och bedöma effektiviteten av hemodynamisk behandling, men det finns inga bevis för att de förbättrar överlevnaden.
Det optimala förbelastningsvärdet väljs individuellt, eftersom det är nödvändigt att ta hänsyn till graden av endotelskada och tillståndet för lymfdränage i lungorna, kamrarnas diastoliska funktion och förändringar i intrathorakalt tryck. Volymen av infusionsbehandlingen väljs så att PCWP inte överstiger plasma-COP (förebyggande av OL) och det sker en ökning av CO. Dessutom beaktas parametrar som kännetecknar lungornas gasutbytesfunktion (paO2 och paO2/FiO2) och förändringar i den radiografiska bilden .
För infusionsbehandling som en del av den riktade behandlingen av sepsis och septisk chock används kristalloida och kolloidala lösningar med i stort sett identiska resultat.
Alla infusionsmedier har både fördelar och nackdelar. Idag, med tanke på resultaten från experimentella och kliniska studier, finns det ingen anledning att föredra någon särskild typ.
- Till exempel, för adekvat korrigering av venöst återflöde och förbelastningsnivå, är det nödvändigt att administrera en volym kristalloider som är 2-4 gånger större än kolloidernas, vilket är förknippat med lösningens särdrag i kroppen. Dessutom är kristalloidinfusion förknippad med en större risk för vävnadsödem, och deras hemodynamiska effekt är kortare än kolloidernas. Samtidigt är kristalloider billigare, påverkar inte koagulationspotentialen och framkallar inte anafylaktoida reaktioner. Baserat på ovanstående bestäms den kvalitativa sammansättningen av infusionsprogrammet beroende på patientens egenskaper, med hänsyn till graden av hypovolemi, fasen av DIC-syndrom, förekomsten av perifert ödem och koncentrationen av albumin i blodserumet, svårighetsgraden av akut lungskada.
- Plasmasubstitut (dextraner, gelatinpreparat, hydroxietylstärkelse) är indicerade vid allvarlig BCC-brist. Hydroxietylstärkelse med en substitutionsgrad på 200/0,5, 130/0,4 och 130/0,42 har en potentiell fördel jämfört med dextraner på grund av en lägre risk för membranläckage och avsaknaden av en kliniskt signifikant effekt på hemostasen.
- Introduktion av albumin under kritiska förhållanden kan öka risken för dödsfall. Ökningen av COP under infusionen är övergående, och sedan, under förhållanden med ökad permeabilitet i kapillärbädden ("kapillärläckage"-syndromet), sker ytterligare extravasation av albumin. Det är möjligt att albumintransfusion endast är användbar om dess koncentration i serum är mindre än 20 g/l och det inte finns några tecken på "läckage" in i interstitiet.
- Användning av kryoplasma är indicerat för konsumtionskoagulopati och minskad blodets koagulationspotential.
- Den utbredda användningen av donerade röda blodkroppar bör begränsas på grund av den höga risken för att utveckla olika komplikationer (APL, anafylaktiska reaktioner etc.). Enligt de flesta experter är den lägsta hemoglobinkoncentrationen hos patienter med svår sepsis 90-100 g/l.
Korrigering av hypotoni
Lågt perfusionstryck kräver omedelbar aktivering av läkemedel som ökar vaskulär tonus och/eller hjärtats inotropa funktion. Dopamin eller noradrenalin är förstahandsval för korrigering av hypotoni hos patienter med septisk chock.
Dopamin (dopmin) vid en dos på <10 mcg/(kg x min) ökar blodtrycket, främst genom att öka CO, och har en minimal effekt på systemiskt kärlmotstånd. Vid höga doser dominerar dess α-adrenerga effekt, vilket leder till arteriell vasokonstriktion, och vid en dos på <5 mcg/(kg x min) stimulerar dopamin dopaminerga receptorer i njur-, mesenteri- och koronarkärl, vilket leder till vasodilatation, ökad glomerulär filtration och Na+-utsöndring.
Noradrenalin ökar medelartärtrycket och ökar glomerulär filtration. Optimering av systemisk hemodynamik under dess verkan leder till förbättring av njurfunktionen utan användning av låga doser dopamin. Studier på senare år har visat att dess isolerade användning, jämfört med en kombination med höga doser dopamin, leder till en statistiskt signifikant minskning av dödligheten.
Adrenalin är ett adrenergt läkemedel med de mest uttalade hemodynamiska biverkningarna. Det har en dosberoende effekt på hjärtfrekvens, medelartärtryck, hjärtminutvolym, vänsterkammarfunktion samt syrgastillförsel och -konsumtion . Emellertid uppstår takyarytmier, försämrat organblodflöde och hyperlaktatemi samtidigt. Därför är användningen av adrenalin begränsad till fall av fullständig refraktäritet mot andra katekolaminer.
Dobutamin är det läkemedel man väljer för att öka CO- och O2-tillförsel och -konsumtion vid normal eller förhöjd preload. På grund av dess övervägande effekt på beta1-adrenerga receptorer är det mer effektivt än dopamin för att öka dessa parametrar.
Experimentella studier har visat att katekolaminer, förutom att stödja blodcirkulationen, kan reglera förloppet av systemisk inflammation genom att påverka syntesen av viktiga mediatorer med en fjärreffekt. Under påverkan av adrenalin, dopamin, noradrenalin och dobutamin minskar aktiverade makrofager syntesen och utsöndringen av TNF-α.
Valet av adrenerga medel utförs enligt följande algoritm:
- hjärtindex 3,5–4 l/(min x m² ), SvO² > 70 % - dopamin eller noradrenalin,
- hjärtindex <3,5 l/(min x m² ), SvO2 <70 % - dobutamin (om systoliskt blodtryck <70 mm Hg - tillsammans med noradrenalin eller dopamin).
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ]
Andningsstöd
Lungorna är bland de första målorganen som är involverade i den patologiska processen vid sepsis. Akut andningssvikt är en av de ledande komponenterna i multipel organdysfunktion. Dess kliniska och laboratoriemässiga manifestationer vid sepsis motsvarar ALI, och med progressionen av den patologiska processen - ARDS. Indikationer för mekanisk ventilation vid svår sepsis bestäms beroende på svårighetsgraden av parenkymatös andningssvikt (ARF eller ARDS). Dess kriterium är respiratoriskt index:
- <200 - trakealintubation och andningsstöd är indicerat,
- >200 - avläsningarna bestäms individuellt.
Om patienten är medvetande under spontan andning med syrgasstöd, det inte finns någon hög belastning på andningsarbetet och uttalad takykardi (HR <120 per minut), det normala värdet för venöst återflöde SO2 > 90%, är det möjligt att avstå från att överföra honom till artificiell ventilation. Det är dock nödvändigt att noggrant övervaka patientens tillstånd. Det optimala värdet för SO2 är cirka 90%. Det kan upprätthållas med olika metoder för gastillförsel (ansiktsmasker, nasala katetrar) i giftfria koncentrationer (FiO2 < 0,6). Icke-invasiv artificiell ventilation är kontraindicerad vid sepsis (evidenskategori B).
Högvolymsmekanisk ventilation (MVV) (VO = 12 ml/kg) bör undvikas, eftersom utsöndringen av cytokiner från lungorna i sådana fall ökar, vilket leder till förvärring av MOF. Det är nödvändigt att följa konceptet säker mekanisk ventilation, vilket är möjligt om följande villkor är uppfyllda (evidenskategori A):
- DO <10 ml/kg,
- icke-inverterat förhållande mellan inandning och utandning,
- maximalt luftvägstryck <35 cm H2O,
- FiO2 <0,6 .
Valet av andningscykelparametrar utförs tills tillräcklig mekanisk ventilation uppnås, dess kriterier är paO2 > 60 mm Hg, SpO2 > 88–93 %, pvO2 35–45 mm Hg, SvO2 > 55 %.
En av de effektiva metoderna för att optimera gasutbytet är att utföra artificiell ventilation i bukläge (Prone Positioning) (evidenskategori B). Denna position är effektiv hos patienter i det svåraste tillståndet, även om dess effekt på att minska dödligheten på lång sikt är statistiskt osignifikant.
Näringsstöd
Att ge artificiellt näringsstöd är en viktig del av behandlingen, en av de obligatoriska åtgärderna, eftersom utvecklingen av multipel organsviktssyndrom vid sepsis vanligtvis åtföljs av manifestationer av hypermetabolism. I en sådan situation tillgodoses energibehovet genom förstörelse av ens egna cellstrukturer (autokannibalism), vilket förvärrar organdysfunktion och ökar endotoxikos.
Näringsstöd betraktas som en metod för att förebygga allvarlig utmattning (protein-energibrist) mot bakgrund av en uttalad ökning av kata- och metabolism. Inkludering av enteral nutrition i komplexet av intensiv terapi förhindrar rörelsen av tarmfloran, dysbakterios, ökar enterocyternas funktionella aktivitet och tarmslemhinnans skyddande egenskaper. Dessa faktorer minskar graden av endotoxikos och risken för sekundära infektiösa komplikationer.
Beräkning av näringsstöd:
- energivärde - 25–35 kcal/(kg kroppsvikt x dag),
- mängd protein - 1,3–2,0 g/(kg kroppsvikt x dag),
- mängd kolhydrater (glukos) - mindre än 6 g/kg/dag,
- mängd fett - 0,5–1 g/kg/dag,
- glutamindipeptider 0,3–0,4 g/kg/dag,
- vitaminer - standard dagligt intag + vitamin K (10 mg/dag) + vitamin B1 och B6 ( 100 mg/dag) + vitamin A, C, E,
- mikroelement - standard dagligt intag + Zn (15-20 mg/dag + 10 mg/dag vid lös avföring),
- elektrolyter - Na+, K+, Ca2+ enligt balansberäkningar och koncentration i plasma.
Tidig insättning av nutritionsstöd (24–36 timmar) är mer effektivt än på 3–4:e dagen av intensivbehandling (evidenskategori B), särskilt vid enteral sondmatning.
Vid svår sepsis finns inga fördelar med enteral eller parenteral nutrition; varaktigheten av organdysfunktion och varaktigheten av andnings- och inotropiskt stöd är desamma, och dödligheten är densamma. Med tanke på ovanstående är tidig enteral nutrition ett billigare alternativ till parenteral nutrition. Användning av blandningar berikade med kostfiber (prebiotika) för sondnäring minskar avsevärt förekomsten av diarré hos patienter med svår sepsis.
För effektiv proteinsyntes i kroppen är det viktigt att bibehålla det metaboliska förhållandet "totalt kväve, g - icke-proteinkalorier, kcal" = 1-(110-130). Den maximala dosen kolhydrater är 6 g / (kg kroppsvikt per dag), eftersom införandet av stora doser hotar hyperglykemi och aktivering av katabolism i skelettmuskler. Fettemulsioner rekommenderas att administreras dygnet runt.
Kontraindikationer för näringsstöd:
- dekompenserad metabolisk acidos,
- individuell intolerans mot näringsstödjande medier,
- svår oåterställd hypovolemi,
- refraktär chock - dopamindos >15 mcg/(kg x min) och systoliskt blodtryck <90 mm Hg,
- svår svårbehandlad arteriell hypoxemi.
Glykemisk kontroll
En viktig aspekt av komplex behandling av svår sepsis är konstant övervakning av glukoskoncentrationen i blodplasma och insulinbehandling. Hög glykemi och behovet av dess korrigering är faktorer som bidrar till ett ogynnsamt utfall vid sepsis. Med tanke på ovanstående omständigheter bibehålls normoglykemi (4,5-6,1 mmol/l) hos patienter, och när glukoskoncentrationen ökar över acceptabla värden utförs insulininfusion (0,5-1 U/h). Beroende på den kliniska situationen övervakas glukoskoncentrationen var 1-4:e timme. Vid implementering av denna algoritm noterades en statistiskt signifikant ökning av patientöverlevnaden.
 [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ]
[ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ]
Glukokortikoider
Resultaten av moderna studier gällande effektiviteten av glukokortikoidanvändning hos patienter med septisk chock sammanfattas i följande uttalanden:
- Det är olämpligt att använda hormoner i höga doser [metylprednisolon 30–120 mg/(kg x dag) en gång eller i 9 dagar, dexametason 2 mg/(kg x dag) i 2 dagar, betametason 1 mg/(kg x dag) i 3 dagar] – ökad risk för sjukhusinfektioner, ingen effekt på överlevnaden,
- Användning av hydrokortison i en dos på 240–300 mg per dag i 5–7 dagar accelererar stabiliseringen av hemodynamiska parametrar, möjliggör utsättning av vaskulärt stöd och förbättrar överlevnaden hos patienter med samtidig relativ binjurebarksvikt (evidenskategori B).
Det är nödvändigt att överge den kaotiska empiriska förskrivningen av prednisolon och dexametason - det finns ingen grund för att extrapolera ny information till dem. I avsaknad av laboratoriebevis för relativ binjurebarksvikt administreras hydrokortison i en dos av 300 mg per dag (i 3-6 injektioner).
- vid refraktär chock,
- om höga doser vasopressorer krävs för att upprätthålla effektiv hemodynamik.
Det är möjligt att vid systemisk inflammation vid septisk chock är hydrokortisons effektivitet associerad med aktiveringen av nukleärfaktor-kB-hämmaren (NF-kB-a) och korrigeringen av relativ binjurebarksvikt. Hämning av aktiviteten hos transkriptionsnukleärfaktorn (NF-kB) leder i sin tur till en minskning av bildandet av inducerbart NO-syntetas (NO är den mest kraftfulla endogena vasodilatorn), proinflammatoriska cytokiner, COX och adhesionsmolekyler.
Aktiverat protein C
En av de karakteristiska manifestationerna av sepsis är en störning av systemisk koagulation (aktivering av koagulationskaskaden och hämning av fibrinolys), vilket i slutändan leder till hypoperfusion och organdysfunktion. Effekten av aktiverat protein C på det inflammatoriska systemet realiseras på flera sätt:
- minskning av selektinbindning till leukocyter, vilket skyddar endotelet från skador, vilket spelar en nyckelroll i utvecklingen av systemisk inflammation,
- minskad frisättning av cytokiner från monocyter,
- blockerar frisättningen av TNF-α från leukocyter,
- hämning av trombinproduktion (det förstärker det inflammatoriska svaret).
Antikoagulerande, profibrinolytisk och antiinflammatorisk verkan
- aktiverat protein C beror på
- nedbrytning av faktorerna Va och VIIIa - hämning av trombbildning,
- hämmande av plasminogenaktivatorhämmare - aktivering av fibrinolys,
- direkt antiinflammatorisk effekt på endotelceller och neutrofiler,
- skydd av endotelet från apoptos
Administrering av aktiverat protein C [drotrecogin alfa (aktiverat)] med 24 mcg/(kg h) i 96 timmar minskar risken för dödsfall med 19,4 %. Indikationer för administrering: sepsis med akut MOF och hög risk för dödsfall (APACHE II > 25 poäng, dysfunktion i 2 eller fler organ, evidenskategori B).
Aktivt protein C minskar inte dödligheten hos barn, patienter med organdysfunktion, APACHE II < 25 poäng, hos patienter med icke-kirurgisk sepsis.
 [ 14 ], [ 15 ], [ 16 ], [ 17 ]
[ 14 ], [ 15 ], [ 16 ], [ 17 ]
Immunglobuliner
Rekommendationen av intravenös administrering av immunglobuliner (IgG och IgG+IgM) är förknippad med deras förmåga att begränsa den överdrivna effekten av proinflammatoriska cytokiner, öka clearance av endotoxiner och stafylokocksuperantigen, eliminera anergi och förstärka effekten av ß-laktamantibiotika. Deras användning vid behandling av svår sepsis och septisk chock är den enda metoden för immunkorrigering som ökar överlevnaden. Den bästa effekten registrerades vid användning av en kombination av IgG och IgM [RR=0,48 (0,35–0,75), evidenskategori A]. Standarddoseringen är 3–5 ml/(kg x dag) i 3 dagar i rad. Vid användning av immunglobuliner erhölls de mest optimala resultaten i den tidiga fasen av chocken ("varmchock") och hos patienter med svår sepsis (APACHE II-poäng på 20–25 poäng).
Förebyggande av djup ventrombos
Förebyggande av DVT i nedre extremiteter påverkar behandlingsresultaten signifikant hos patienter med sepsis (evidenskategori A). Både ofraktionerade och lågmolekylära hepariner används för detta ändamål. De främsta fördelarna med lågmolekylära hepariner är en lägre incidens av hemorragiska komplikationer, en svagare effekt på trombocytfunktionen och en långvarig effekt (kan administreras en gång dagligen).
Förebyggande av bildandet av stresssår i mag-tarmkanalen
Denna riktning spelar en betydande roll för ett gynnsamt resultat vid behandling av patienter med svår sepsis och septisk chock, eftersom dödligheten för blödning från stresssår i mag-tarmkanalen är 64–87 %. Utan förebyggande åtgärder uppstår stresssår hos 52,8 % av kritiskt sjuka patienter. Användningen av protonpumpshämmare och histamin H2-receptorblockerare minskar dock risken med mer än 2 gånger (den första gruppen läkemedel är mer effektiv än den andra). Huvudinriktningen för förebyggande och behandling är att upprätthålla pH-värdet inom 3,5–6,0. Det bör betonas att utöver ovanstående läkemedel spelar enteral nutrition en viktig roll för att förhindra bildandet av stresssår.
Extrakorporeal blodrening
Olika biologiskt aktiva substanser och metaboliska produkter som är involverade i utvecklingen av generaliserad inflammation är mål för avgiftningsmetoder, vilket är särskilt viktigt i avsaknad av naturlig hepatorenal clearance vid tillstånd med multipel organsvikt. Njurersättningsterapi anses vara lovande, eftersom de inte bara kan påverka uremiska störningar hos patienter med njursvikt, utan också ha en positiv effekt på andra förändringar i homeostas och organdysfunktioner som uppstår vid sepsis, chock och multipel organsvikt.
Hittills finns det inga data som bekräftar behovet av att använda extrakorporeala blodreningsmetoder som en av huvudinriktningarna för patogenetisk behandling av sepsis och septisk chock. Deras användning är motiverad vid multiorgansvikt med njurdominans.
 [ 18 ], [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ]
[ 18 ], [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ]
Hemodialys
Metodens kärna är diffusion av ämnen med låg molekylvikt (upp till 5x10³ Da ) genom ett semipermeabelt membran och avlägsnande av överskottsvätska från kroppen längs en tryckgradient. Hemodialys används ofta för att behandla patienter med både kronisk och akut njursvikt. Diffusionshastigheten för ämnen beror exponentiellt på deras molekylvikt. Till exempel är avlägsnandet av oligopeptider långsammare än deras syntes.
Hemofiltrering
Hemofiltrering är en effektiv metod för att avlägsna ämnen med en molekylvikt på 5x10³ - 5x10⁴ Da och det enda sättet att avlägsna en stor grupp biologiskt aktiva ämnen och metaboliter från kroppen. Metoden är baserad på konvektionsmetoden för massöverföring. Förutom adekvat korrigering av azotemi avlägsnar hemofiltrering effektivt anafylatoxinerna C3a, C5a, proinflammatoriska cytokiner (TNF-α, IL-1b, 6 och 8), ß2-mikroglobulin, myoglobin, bisköldkörtelhormon, lysozym (molekylvikt - 6000 Da), α-amylas (molekylvikt - 36 000-51 000 Da), kreatinfosfokinas, alkaliskt fosfatas, transaminaser och andra ämnen. Hemofiltrering avlägsnar aminosyror och plasmaproteiner (inklusive immunoglobuliner och cirkulerande immunkomplex).
Hemodiafiltrering
Hemodiafiltrering är den mest kraftfulla metoden för blodrening, som kombinerar diffusion och konvektion (dvs. GD och GF). Ett ytterligare bidrag till avgiftningsprocessen görs genom sorptionen av patologiska ämnen på filtermembranet.
Plasmaferes
Plasmaferes (plasmabyte, plasmafiltrering) anses också vara en möjlig metod för att korrigera generaliserad inflammation hos patienter med sepsis och septisk chock. Den optimala metoden anses vara användning av plasmabyte i kontinuerligt läge med avlägsnande av 3-5 volymer plasma och samtidig ersättning med färskfryst, albumin-, kolloidal och kristalloid lösning. Med en siktningskoefficient på 1 säkerställer plasmafiltrering god avlägsnande av C-reaktivt protein, haptoglobin, komplementfragment C3, 1-antitrypsin, IL-6, tromboxan-B2, granulocytstimulerande faktor, TNF. Användningen av sorbenter för att rena patientens plasma minskar risken för infektion och kostnaden för proceduren, eftersom det inte finns något behov av att använda främmande proteiner.
Användning av långvarig infusion av natriumselenit (selenas) 1000 mcg/dag vid svår sepsis leder till en minskad dödlighet.
Selen är ett essentiellt mikroelement vars betydelse är förknippad med dess nyckelroll i cellernas antioxidantsystem. Selennivån i blodet hålls inom 1,9–3,17 μM/l. Behovet av selen är 50–200 μg per dag, och det beror på tillgången på andra antioxidanter och mikroelement.
Selen är en kraftfull antioxidant, en komponent i glutationperoxidas, fosfolinglutationperoxidas, andra oxidoreduktaser och vissa transferaser. Glutationperoxidas är den viktigaste länken i det endogena antioxidantsystemet.
Selens effektivitet under kritiska förhållanden har studerats under senare år. Dessa studier har visat att selenets huvudsakliga verkningsmekanismer är:
- undertryckande av NF-kB-hyperaktivering;
- minskad komplementaktivering;
- dess verkan som immunmodulator, antioxidant och antiinflammatoriskt medel
- upprätthålla peroxidutnyttjande;
- undertryckande av endoteladhesion (minskat uttryck av ICAM-1, VCAM-2,
- E - selektin, P - selektin);
- skydd av endotelet från oxiradikaler (med hjälp av selenoprotein P, vilket förhindrar bildandet av peroxynitrit från O2 och NO).
För att sammanfatta ovanstående kan vi definiera specifika uppgifter inom intensivvården för svår sepsis:
- Hemodynamiskt stöd: CVP 8–12 mm Hg, medeltryck >65 mm Hg, diures 0,5 ml/(kg h), hematokrit >30 %, blandad venös blodmättnad >70 %.
- Andningsstödjande maximalt luftvägstryck <35 cm H2O, inspiratorisk syrgasfraktion <60 %, tidalvolym <10 ml/kg, icke-inverterat inandnings-/exspiratoriskt förhållande.
- Glukokortikoider – "låga doser" (hydrokortison 240–300 mg per dag).
- Aktivt protein C 24 mcg/(kg h) i 4 dagar vid svår sepsis (APACHE II >25).
- Immunkorrigerande ersättningsterapi med pentaglobin.
- Förebyggande av djup ventrombos i nedre extremiteterna.
- Förebyggande av bildandet av stressår i mag-tarmkanalen: användning av protonpumpshämmare och H2-histaminreceptorblockerare.
- Ersättningsterapi för akut njursvikt.
- Näringsstöd: energivärde i maten 25–30 kcal/kg kroppsvikt x dag), protein 1,3–2,0 g/(kg kroppsvikt x dag), glutamindipeptider 0,3–0,4 g/(kg x dag), glukos - 30–70 % av icke-proteinkalorierna, förutsatt att glykemin hålls <6,1 mmol/l, fetter - 15–50 % av icke-proteinkalorierna.

