Slutet system för läkemedelsleverans kan förbättra kemoterapi
Senast recenserade: 14.06.2024

Allt iLive-innehåll är mediekontrollerat eller faktiskt kontrollerat för att säkerställa så mycket faktuell noggrannhet som möjligt.
Vi har strikta sourcing riktlinjer och endast länk till välrenommerade media webbplatser, akademiska forskningsinstitut och, när det är möjligt, medicinsk peer granskad studier. Observera att siffrorna inom parentes ([1], [2] etc.) är klickbara länkar till dessa studier.
Om du anser att något av vårt innehåll är felaktigt, omodernt eller på annat sätt tveksamt, välj det och tryck på Ctrl + Enter.
När cancerpatienter genomgår kemoterapi beräknas doser av de flesta läkemedel baserat på patientens kroppsyta. Denna indikator uppskattas med hjälp av en ekvation där patientens längd och vikt ersätts. Denna ekvation formulerades 1916 baserat på data från bara nio patienter.
Detta förenklade tillvägagångssätt för dosering tar inte hänsyn till andra faktorer och kan leda till att patienten ordineras för mycket eller för lite av läkemedlet. Som ett resultat kan vissa patienter uppleva överdriven toxicitet eller bristande effektivitet av sin kemoterapi.
För att förbättra kemoterapidoseringens noggrannhet har MIT-ingenjörer utvecklat ett alternativt tillvägagångssätt som gör att dosen kan anpassas för varje patient. Deras system mäter mängden läkemedel i patientens kropp, och dessa data läggs in i kontrollenheten, som kan justera infusionshastigheten därefter.
Det här tillvägagångssättet kan hjälpa till att kompensera för skillnader i läkemedels farmakokinetik orsakade av kroppssammansättning, genetisk predisposition, kemoterapi-inducerad organtoxicitet, interaktioner med andra mediciner och livsmedel, och dygnsrytmfluktuationer i enzymer som är ansvariga för att bryta ner kemoterapiläkemedel, säger forskarna. p>
"Genom att erkänna framsteg när det gäller att förstå hur läkemedel metaboliseras och tillämpa tekniska verktyg för att förenkla personlig dosering tror vi att vi kan hjälpa till att förändra säkerheten och effektiviteten hos många läkemedel", säger Giovanni Traverso, biträdande professor i maskinteknik vid MIT och en gastroenterolog på sjukhuset. Brigham and Women's Hospital och senior författare till studien.
Louis DeRidder, en doktorand vid MIT, är huvudförfattare till artikeln publicerad i Med.
Kontinuerlig övervakning
I denna studie fokuserade forskarna på ett läkemedel som heter 5-fluorouracil, som används för att behandla kolorektal cancer och andra typer av cancer. Läkemedlet administreras vanligtvis under en 46-timmarsperiod och doseringen bestäms med hjälp av en formel baserad på patientens längd och vikt, vilket ger en uppskattning av kroppsytan.
Men detta tillvägagångssätt tar inte hänsyn till skillnader i kroppssammansättning, som kan påverka fördelningen av läkemedlet i kroppen, eller genetiska variationer som påverkar dess ämnesomsättning. Dessa skillnader kan leda till skadliga biverkningar om det finns för mycket av läkemedlet. Om läkemedlet inte räcker kan det hända att det inte dödar tumören som förväntat.
"Människor med samma kroppsyta kan ha väldigt olika höjder och vikter, olika muskelmassa eller genetiska egenskaper, men så länge som höjden och vikten i denna ekvation ger samma kroppsyta är deras dos identisk." säger DeRidder, doktorand inom medicinteknik och medicinsk fysik vid Harvard-MIT Health Sciences and Technology Program.
En annan faktor som kan förändra mängden läkemedel i blodet vid varje given tidpunkt är dygnsfluktuationen av ett enzym som kallas dihydropyrimidindehydrogenas (DPD), som bryter ner 5-fluorouracil. Uttrycket av DPD, liksom många andra enzymer i kroppen, regleras av en dygnsrytm. Således är nedbrytningen av 5-FU DPD inte konstant, utan varierar beroende på tid på dygnet. Dessa dygnsrytmer kan resultera i tiofaldiga fluktuationer i mängden 5-fluorouracil i en patients blod under loppet av en infusion.
"Genom att använda kroppsyta för att beräkna kemoterapidos vet vi att två personer kan ha helt olika toxiciteter än 5-fluorouracil. En patient kan ha behandlingscykler med minimal toxicitet och sedan en cykel med fruktansvärd toxicitet. Något förändrades i hur detta patientmetaboliserad kemoterapi från en cykel till nästa Vår föråldrade doseringsmetod fångar inte upp dessa förändringar, och patienterna lider som ett resultat, säger Douglas Rubinson, klinisk onkolog vid Dana-Farber Cancer Institute och författare till artikeln.
Ett sätt att försöka kompensera för variationer i farmakokinetiken för kemoterapi är en strategi som kallas terapeutisk läkemedelsövervakning, där patienten ger ett blodprov i slutet av en behandlingscykel. Efter att detta prov har analyserats för läkemedelskoncentrationer, kan dosen justeras, om nödvändigt, i början av nästa cykel (vanligtvis efter två veckor för 5-fluorouracil).
Detta tillvägagångssätt har visat sig leda till bättre resultat för patienter, men har inte använts i stor utsträckning för kemoterapier som 5-fluorouracil.
MIT-forskare ville utveckla en liknande typ av övervakning, men på ett automatiserat sätt som kunde anpassa läkemedelsdoseringen i realtid, vilket skulle kunna leda till bättre resultat för patienterna.
I deras slutna system kan läkemedelskoncentrationer övervakas kontinuerligt och denna information används för att automatiskt justera kemoterapiläkemedelsinfusionshastigheten för att hålla dosen inom målintervallet.
Detta system med slutna kretslopp gör att läkemedelsdosering kan anpassas för att ta hänsyn till dygnsrytmer av förändrade nivåer av läkemedelsmetaboliserande enzymer, såväl som eventuella förändringar i patientens farmakokinetik sedan senaste behandling, såsom kemoterapi-inducerad organtoxicitet.
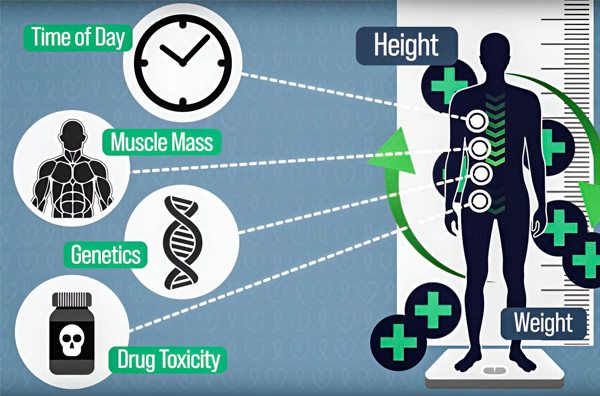
För att göra kemoterapidoseringen mer exakt har MIT-ingenjörer utvecklat ett sätt att kontinuerligt mäta mängden läkemedel i en patients kropp under en timmar lång infusion. Detta kommer att hjälpa till att kompensera för skillnader orsakade av kroppssammansättning, genetik, läkemedelstoxicitet och dygnsfluktuationer. Källa: Tillhandahålls av forskare.
Det nya systemet som utvecklats av forskarna, känt som CLAUDIA (Closed-Loop AUtomated Drug Infusion regulAtor), använder kommersiellt tillgänglig utrustning för varje steg. Blodprover tas var femte minut och förbereds snabbt för analys. Koncentrationen av 5-fluorouracil i blodet mäts och jämförs med målintervallet.
Skillnaden mellan målkoncentrationen och den uppmätta koncentrationen läggs in i kontrollalgoritmen, som sedan justerar infusionshastigheten vid behov för att hålla dosen inom det koncentrationsområde där läkemedlet är effektivt och icke-toxiskt.
"Vi har utvecklat ett system där vi kontinuerligt kan mäta läkemedelskoncentrationer och justera infusionshastigheten därefter för att bibehålla läkemedelskoncentrationerna inom det terapeutiska fönstret", säger DeRidder.
Snabb justering
I djurförsök fann forskarna att med CLAUDIA kunde de hålla mängden läkemedel som cirkulerade i kroppen inom målintervallet cirka 45 procent av tiden.
Läkemedelsnivåer hos djur som fick kemoterapi utan CLAUDIA förblev inom målintervallet endast 13 procent av tiden i genomsnitt. I den här studien testade forskarna inte effektiviteten av läkemedelsnivåer, men bibehållande av koncentrationer inom målfönstret antas resultera i bättre resultat och mindre toxicitet.
CLAUDIA kunde också upprätthålla dosen av 5-fluorouracil inom målintervallet även när det administrerades ett läkemedel som hämmar DPD-enzymet. Hos djur som behandlats med denna hämmare utan kontinuerlig övervakning och justering ökade 5-fluorouracilnivåerna upp till åtta gånger.
För den här demonstrationen utförde forskarna varje steg i processen manuellt med hjälp av utrustning från hyllan, men planerar nu att automatisera varje steg så att övervakning och dosjusteringar kan göras utan mänsklig inblandning.
För att mäta läkemedelskoncentrationer använde forskarna högpresterande vätskekromatografi-masspektrometri (HPLC-MS), en teknik som kan anpassas för att detektera praktiskt taget alla typer av läkemedel.
"Vi föreställer oss en framtid där vi kan använda CLAUDIA för vilket läkemedel som helst som har lämpliga farmakokinetiska egenskaper och som kan detekteras med HPLC-MS, vilket möjliggör personlig dosering för många olika läkemedel", säger DeRidder.
