Nya publikationer
Ny studie avslöjar mitokondriella proteiners nyckelroll vid hjärtförnyelse
Senast recenserade: 02.07.2025

Allt iLive-innehåll är mediekontrollerat eller faktiskt kontrollerat för att säkerställa så mycket faktuell noggrannhet som möjligt.
Vi har strikta sourcing riktlinjer och endast länk till välrenommerade media webbplatser, akademiska forskningsinstitut och, när det är möjligt, medicinsk peer granskad studier. Observera att siffrorna inom parentes ([1], [2] etc.) är klickbara länkar till dessa studier.
Om du anser att något av vårt innehåll är felaktigt, omodernt eller på annat sätt tveksamt, välj det och tryck på Ctrl + Enter.
Mitokondrier spelar en avgörande roll i att tillhandahålla den energi som behövs för korrekt cellfunktion. I mitokondrier produceras energi av andningskedjan, som består av fem komplex, betecknade CI-CV. Dessa komplex kan sammanfogas till superkomplex, men lite är känt om rollen för denna process och dess kontroll.
Den nya studien undersöker mekanismerna för superkomplexbildning och avslöjar en signifikant inverkan av mitokondriella samlingsfaktorer på hjärtvävnadsregenerering. Studien leddes gemensamt av Dr. José Antonio Enríquez från National Center for Cardiovascular Research (CNIC) och Dr. Nadia Mercader från Berns universitet i Schweiz, som är gästforskare vid CNIC.
En studie publicerad i tidskriften Developmental Cell visar att proteinfamiljemedlemmen Cox7a spelar en grundläggande roll i sammansättningen av CIV-dimerer och att denna sammansättning är avgörande för mitokondriernas korrekta funktion och därmed för cellulär energiproduktion.
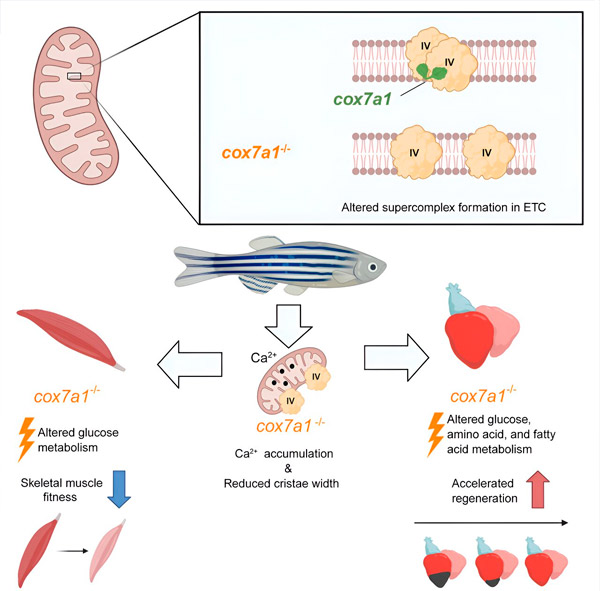
Proteinfamiljen Cox7a omfattar tre medlemmar: Cox7a1, Cox7a2 och Cox7a2l (även kallad SCAF1). Tidigare studier av båda grupperna har visat att när CIV innehåller SCAF1, associerar det starkt med CIII och bildar ett respiratoriskt superkomplex känt som respirasomen. I dessa tidigare studier antog författarna att inkludering av Cox7a2 skulle resultera i ett CIV som inte kan associera, medan CIV-molekyler som innehåller Cox7a1 skulle associera för att bilda CIV-homodimerer. Den nya studien visar experimentellt en roll för Cox7a1 i bildandet av dessa CIV-homodimerer.
Utvecklingscell (2024). DOI: 10.1016/j.devcel.2024.04.012
Forskarna arbetade med en zebrafiskmodell och fann att frånvaron av Cox7a1 förhindrade bildandet av CIV-dimerer, och förlusten av dessa dimerer påverkade de drabbade fiskarnas vikt och simförmåga.
”Cox7a1 uttrycks främst i tvärstrimmiga muskelceller, och det var skelettmuskelvävnad som led mest av bristen på Cox7a1-funktion. Den andra viktiga typen av tvärstrimmig muskel är hjärtmuskeln, eller myokardiet”, förklarade Dr. Enriquez.
Emellertid, medan förlusten av Cox7a1 i skelettmuskulaturen var skadlig, förbättrade dess frånvaro i hjärtmuskeln det kardiale regenerativa svaret på skada.
"Detta resultat visar att dessa proteiner spelar en nyckelroll i att aktivera hjärtats förmåga att reparera sig själv efter en skada", förklarade studiens förstaförfattare, Carolina Garcia-Pojatos.
För att ytterligare utforska funktionen hos Cox7a1 genomförde CNIC-forskarna Enrique Calvo och Jesús Vásquez en proteomisk studie av skelettmuskulatur och hjärtmuskel hos zebrafiskar som saknar Cox7a1. Denna analys kompletterades av en metabolomikstudie utförd av kollegor vid Berns universitet. Denna kombinerade analys avslöjade signifikanta skillnader jämfört med omodifierade fiskar med intakt Cox7a1-uttryck.
"Dessa resultat tyder på att molekyler som är involverade i sammansättningen av mitokondriella superkomplex kan ha betydande effekter på metabolisk kontroll, vilket möjligen öppnar vägen för nya behandlingar för hjärtsjukdomar och andra metaboliska tillstånd", säger Dr. Mercader.
Enligt forskargruppen representerar denna upptäckt "ett betydande steg framåt i förståelsen av de cellulära mekanismer som är involverade i hjärtregenerering och kan peka vägen för utvecklingen av terapier som syftar till att stimulera hjärtregenerering."
Författarna drar slutsatsen att mitokondriella sammansättningsfaktorer kan påverka metabolisk kontroll avsevärt.
