Nya publikationer
Forskare har skapat en "kameleont"-förening för behandling av läkemedelsresistent hjärncancer
Senast recenserade: 02.07.2025

Allt iLive-innehåll är mediekontrollerat eller faktiskt kontrollerat för att säkerställa så mycket faktuell noggrannhet som möjligt.
Vi har strikta sourcing riktlinjer och endast länk till välrenommerade media webbplatser, akademiska forskningsinstitut och, när det är möjligt, medicinsk peer granskad studier. Observera att siffrorna inom parentes ([1], [2] etc.) är klickbara länkar till dessa studier.
Om du anser att något av vårt innehåll är felaktigt, omodernt eller på annat sätt tveksamt, välj det och tryck på Ctrl + Enter.
En ny studie av forskare vid Yale University beskriver hur en ny kemisk förening angriper läkemedelsresistenta hjärntumörer utan att skada frisk omgivande vävnad.
Studien, som publicerades i Journal of the American Chemical Society, är ett viktigt steg i utvecklingen av så kallade "kameleontföreningar" som skulle kunna användas för att bekämpa en rad farliga cancerformer.
Gliom utvecklas hos cirka 6,6 per 100 000 personer varje år och hos 2,94 per 100 000 personer vid 14 års ålder. Om man bortser från metastaser från andra cancerformer som når centrala nervsystemet står gliom för 26 % av alla hjärntumörer (primära hjärntumörer) och 81 % av alla maligna hjärntumörer.
I årtionden har patienter med glioblastom behandlats med ett läkemedel som heter temozolomid. De flesta patienter utvecklar dock resistens mot temozolomid inom ett år. Femårsöverlevnaden för patienter med glioblastom är mindre än 5 %.
År 2022 utvecklade Yale-kemisten Seth Herzon och strålningsonkologen Dr. Ranjit Bindra en ny strategi för att behandla glioblastom mer effektivt. De skapade en klass av anticancermolekyler som kallas kameleontföreningar, vilka utnyttjar en defekt i ett DNA-reparationsprotein som kallas O6-metylguanin-DNA-metyltransferas (MGMT).
Många cancerceller, inklusive glioblastom, saknar MGMT-proteinet. Nya kameleontföreningar är utformade för att skada DNA i tumörceller som saknar MGMT.
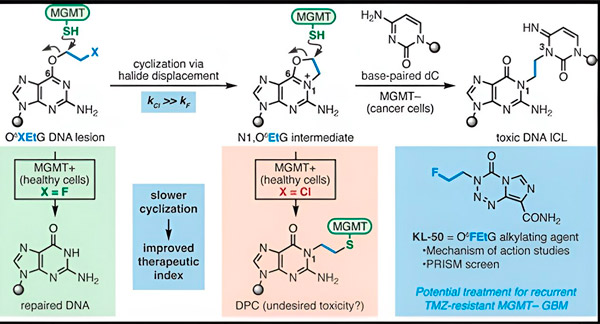
Kameleontföreningar initierar DNA-skador genom att avsätta primära lesioner på DNA som med tiden utvecklas till mycket giftiga sekundära lesioner, så kallade interstrand-tvärbindningar. MGMT skyddar DNA:t i friska vävnader genom att reparera primära lesioner innan de kan utvecklas till dödliga interstrand-tvärbindningar.
För sin nya studie fokuserade medförfattarna Herzon och Bindra på sin ledande kameleont, KL-50.
"Vi använde en kombination av syntetisk kemi och molekylärbiologiska studier för att belysa den molekylära grunden för våra tidigare observationer, såväl som den kemiska kinetiken som ger den unika selektiviteten hos dessa föreningar", säger Herzon, Milton Harris-professor i kemi vid Yale. "Vi visar att KL-50 är unik genom att den endast bildar DNA-tvärbindningar i tumörer med defekt DNA-reparation. Den skonar frisk vävnad."
Källa: Journal of the American Chemical Society (2024). DOI: 10.1021/jacs.3c06483
Det är en betydande skillnad, påpekar forskarna. Ett antal andra anticancerföreningar har utformats för att utlösa tvärbindningar mellan strängar, men de är inte selektiva för tumörceller, vilket begränsar deras användbarhet.
Hemligheten bakom KL-50:s framgång ligger i dess timing, konstaterade forskarna. KL-50 bildar tvärbindningar mellan strängarna långsammare än andra tvärbindare. Denna fördröjning ger friska celler tillräckligt med tid att använda MGMT för att förhindra att tvärbindningar bildas.
”Denna unika profil antyder dess potential för behandling av läkemedelsresistent glioblastom, ett område med ett stort ouppfyllt behov i kliniken”, säger Bindra, Harvey och Kate Cushing-professor i terapeutisk radiologi vid Yale School of Medicine. Bindra är också vetenskaplig chef för Chenevert Family Brain Tumor Center på Smilo Hospital.
Herzon och Bindra sa att deras studie belyser vikten av att beakta hastigheten för kemisk DNA-modifiering och biokemisk DNA-reparation. De tror att de kan använda denna strategi för att utveckla behandlingar för andra cancerformer som innehåller specifika tumörassocierade DNA-reparationsdefekter.
