Läkemedlet LM11A-31 bromsar utvecklingen av Alzheimers sjukdom i försök
Senast recenserade: 14.06.2024

Allt iLive-innehåll är mediekontrollerat eller faktiskt kontrollerat för att säkerställa så mycket faktuell noggrannhet som möjligt.
Vi har strikta sourcing riktlinjer och endast länk till välrenommerade media webbplatser, akademiska forskningsinstitut och, när det är möjligt, medicinsk peer granskad studier. Observera att siffrorna inom parentes ([1], [2] etc.) är klickbara länkar till dessa studier.
Om du anser att något av vårt innehåll är felaktigt, omodernt eller på annat sätt tveksamt, välj det och tryck på Ctrl + Enter.

I en nyligen publicerad studie publicerad i Nature Medicine genomförde forskare en randomiserad, dubbelblind, placebokontrollerad fas 2a-studie för att undersöka säkerheten och effektiviteten av LM11A-31 vid behandling av Alzheimers sjukdom (AD) genom modulering av p75 neurotrofinreceptorn (p75NTR).
Sent debuterande AD är den vanligaste formen av demens, som kännetecknas av synaptisk svikt, degeneration och förlust av nervceller. Även om de två huvudsakliga läkemedlen för behandling av AD är inriktade på ackumulering av onormalt amyloid-β- eller tau-protein, adresserar de endast en del av patofysiologin. Ett annat tillvägagångssätt är att rikta in sig på receptorer och signalnätverk som påverkar grundläggande biologiska vägar. Prekliniska studier visar att modulering av p75NTR med den nya lilla molekylen LM11A-31 minskar synaptisk förlust orsakad av amyloid och patologisk tau.
Beskrivning av studien
I denna randomiserade kliniska prövning undersökte forskare om LM11A-31 kunde bromsa utvecklingen av Alzheimers sjukdom genom att modulera p75NTR hos människor.
Deltagarna i studien fick orala kapslar av LM11A-31 i doser på 200 mg och 400 mg eller placebo i förhållandet 1:1:1 till 242 patienter med mild till måttlig astma under 26 veckor. Deltagarna hade biologiskt bekräftad Alzheimers sjukdom (nivån av amyloid β-protein 42 (Aβ42) i cerebrospinalvätskan under 550 ng/L eller förhållandet Aβ42:β40 under 0,89), diagnostiserad enligt McKhann-kriterier, med Mini Psychiatric SE (MMSE) poäng på 18 till 26 Geriatric Depression Scale (GDS) poäng under 5,0, modifierad Hacinski Ischemic Scale (HIS) poäng ≤ 4,0, formell utbildning ≥ 8 år och tidigare kognitiv försämring ≥ 6 månader.
Berättigade deltagare hade tagit acetylkolinesterashämmare (AChEI) eller partiella NMDA-receptorantagonister ≥ 3 månader innan studiestart. De tog inte otillåtna läkemedel som antipsykotika, bensodiazepiner, antiepileptika, lugnande medel, centralt aktiva blodtryckssänkande läkemedel, nootropika (förutom ginkgo biloba) eller smärtstillande medel som innehåller opioider.
Det primära resultatet av studien var läkemedelssäkerhet och tolerabilitet bedömd av Columbia Suicidal Ideation and Behavior Severity Rating Scale (C-SSRS), vitala tecken, blodtryck och hematologiska parametrar. Strukturell magnetisk resonanstomografi (sMRI), fluorodeoxiglukos positron emissionstomografi (FDG-PET) och cerebrospinalvätska (CSF) biomarkörer användes för att bedöma sekundära kognitiva resultat. AD-indikatorer inkluderade tau fosforylerad vid Thr181, totalt tau-protein, Aβ40, Aβ42 och AChE-aktivitet. Teamet använde ett individualiserat neuropsykologiskt test för att bedöma sekundära kognitiva resultat vid baslinjen, veckorna 12 och 26.
Forskningsresultat
Studien fann att LM11A-31 var säker och väl tolererad, utan några betydande säkerhetsproblem. De vanligaste biverkningarna var huvudvärk, diarré, eosinofili och nasofaryngit, med gastrointestinala problem och eosinofili som de främsta orsakerna till att behandlingen avbröts. Det gjordes fler utsättningar i 400 mg-gruppen jämfört med 200 mg- och placebogruppen. MRT visade inga problem med läkemedelssäkerheten, inklusive amyloidrelaterade abnormiteter. Det fanns inga signifikanta skillnader i kognitiva poäng eller amyloidavvikelser mellan de två behandlingsgrupperna.
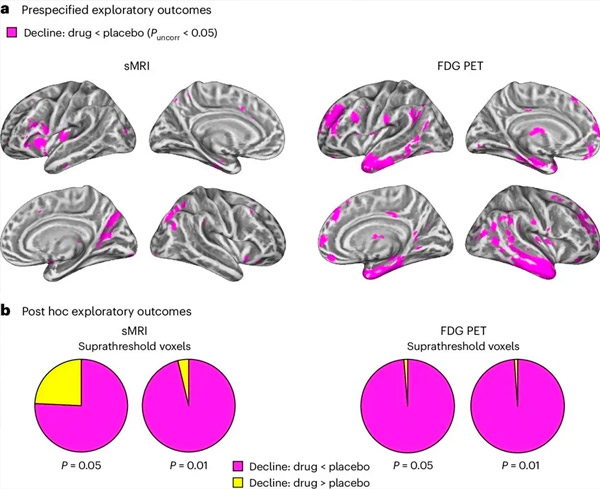
A. Tvåfaktors blandade modeller analyser av kovarians undersökte interaktioner mellan behandling (läkemedel eller placebo) och tid (före eller efter behandling). En enkelriktad t-kontrast som undersökte interaktionshypotesen (läkemedlet bromsar progressionen jämfört med placebo) visade att LM11A-31-behandling bromsade longitudinell degeneration (vänster paneler) och glukoshypometabolism (höger paneler) i den läkemedelsbehandlade gruppen (cMRI, n = 127; PET, n = 121), jämfört med placebogruppen (sMRI, n = 66; PET, n = 62). Voxlar som visar denna interaktion visas vid den okorrigerade tröskeln P < 0,05 (magenta färg) på en populationsspecifik kortikal yta. Den vänstra och högra halvklotet visas i de övre respektive nedre raden. Hjärnregioner som visar interaktioner som inte överensstämmer med hypotesen visas i figur 7 i tilläggsdata. LM11A-31 minskade effektivt ökningen av Aβ42 och Aβ40 i CSF jämfört med placebogruppen. Läkemedlet visade också en minskning av den genomsnittliga årliga procentuella förändringen i den presynaptiska proteinbiomarkören SNAP25 och en minskning av den postsynaptiska biomarkören NG, vilket tyder på en nedgång i förlusten av presynaptiska och postsynaptiska kopplingar. LM11A-31 minskade också YKL40-tillväxten, vilket resulterade i minskade MMSE-poäng och ökade ADAS-Cog-13-poäng. Läkemedlet minskade också förlusten av grå substans i frontalloben och bakre parietalbarken och minskade glukosmetabolismen i områden som entorhinal cortex, temporal cortex, hippocampus, insular cortex och prefrontal cortex. Studien drog slutsatsen att modulering av p75NTR med LM11A-31 är lämplig för större kliniska prövningar. LM11A-31 uppfyllde det primära säkerhetskriteriet och tolererades väl av patienter med mild till svår astma. Resultaten indikerar behovet av ytterligare studier med längre behandlingstid för att utvärdera möjligheten att använda små molekyler för att reglera p75NTR som en sjukdomsmodifierande terapi vid AD. Studien fann att LM11A-31 signifikant påverkade flera biomarkörer, inklusive Aβ40, Aβ42, SNAP25, NG och YKL40, vilket indikerar försvagning av patologisk utveckling. Framtida studier kan utvärdera ytterligare indikatorer på gliahälsa.
b. Totalt antal voxlar i fördefinierade sårbara AD-hjärnregioner (total yta av cirkeldiagram) som visar antingen hypoteskonsistent interaktion (magentfärg) eller hypotesinkonsekvent interaktion (gul färg) i var och en av avbildningsmodaliteterna (cMRI, vänster panel; FDG PET, höger panel) vid allt mer liberala ojusterade P-trösklar < 0,01 och P Slutsats
