Nya publikationer
Forskare upptäcker ny immunosuppressiv mekanism vid hjärncancer
Senast recenserade: 02.07.2025

Allt iLive-innehåll är mediekontrollerat eller faktiskt kontrollerat för att säkerställa så mycket faktuell noggrannhet som möjligt.
Vi har strikta sourcing riktlinjer och endast länk till välrenommerade media webbplatser, akademiska forskningsinstitut och, när det är möjligt, medicinsk peer granskad studier. Observera att siffrorna inom parentes ([1], [2] etc.) är klickbara länkar till dessa studier.
Om du anser att något av vårt innehåll är felaktigt, omodernt eller på annat sätt tveksamt, välj det och tryck på Ctrl + Enter.
Docent Filippo Veglia, Ph.D., och hans team vid Wistar Institute har upptäckt en nyckelmekanism genom vilken glioblastom – en allvarlig och ofta dödlig hjärncancer – undertrycker immunförsvaret så att tumören kan växa oavskräckt av kroppens försvar.
Deras upptäckt publicerades i artikeln "Glucose-driven histone lactylation promotes the immunosuppressive activity of monocyte-derived macrophages in glioblastoma" i tidskriften Immunity.
"Vår studie visar att cancerns självförstärkande mekanismer, om de förstås tillräckligt, kan utnyttjas mot sjukdomen mycket effektivt", säger Dr. Veglia.
"Jag ser fram emot framtida studier av metabolismmedierade immunsuppressiva mekanismer vid glioblastom och hoppas att vi kommer att fortsätta lära oss mer om hur vi bättre kan förstå och bekämpa denna cancer."
Hittills har lite studerats hur monocyt-deriverade makrofager och mikroglia skapar en immunsuppressiv tumörmikromiljö i glioblastom.
Veglia-laboratoriet undersökte de cellulära mekanismerna för immunsuppression vid glioblastom och fann att allt eftersom glioblastom fortskrider börjar monocyt-deriverade makrofager bli fler än mikroglia, vilket tyder på att dominansen av monocyt-deriverade makrofager i tumörmikromiljön är fördelaktig för cancer när det gäller immunundvikelse.
Monocyt-deriverade makrofager, men inte mikroglia, blockerade visserligen aktiviteten hos T-celler (immunceller som dödar tumörceller) i prekliniska modeller och hos patienter. Teamet bekräftade detta genom att utvärdera prekliniska glioblastommodeller med artificiellt reducerat antal monocyt-deriverade makrofager.
Som förväntat visade modeller med färre maligna makrofager i tumörmikromiljön förbättrade resultat jämfört med standardmodeller för glioblastom.
Glioblastom står för drygt hälften av alla maligna tumörer som uppstår i hjärnan, och prognosen för patienter som diagnostiseras med sjukdomen är extremt dålig: endast 25 % av patienterna överlever det första året efter diagnosen. Glioblastom är farligt inte bara på grund av sin placering i hjärnan, utan också på grund av den immunsuppressiva tumörmikromiljön, vilket gör glioblastom resistent mot lovande immunterapier.
Genom att programmera vissa immunceller, såsom makrofager (monocyt-deriverade makrofager och mikroglia), att arbeta för tumören snarare än emot den, skapar glioblastom en tumörmikromiljö för sig själv som gör att cancern kan växa aggressivt samtidigt som den undviker immunsvar mot cancer.
Förtydligande av mekanismen
Efter att ha bekräftat rollen av monocyt-deriverade makrofager, försökte Weglias laboratorium sedan förstå exakt hur dessa cancerassocierade immunceller fungerar mot immunförsvaret.
De sekvenserade makrofagerna för att avgöra om cellerna hade några onormala genuttrycksmönster som kunde tyda på gener som spelar en roll i immunsuppression, och de undersökte också makrofagernas metaboliska mönster för att se om det onormala genuttrycket var relaterat till metabolism.
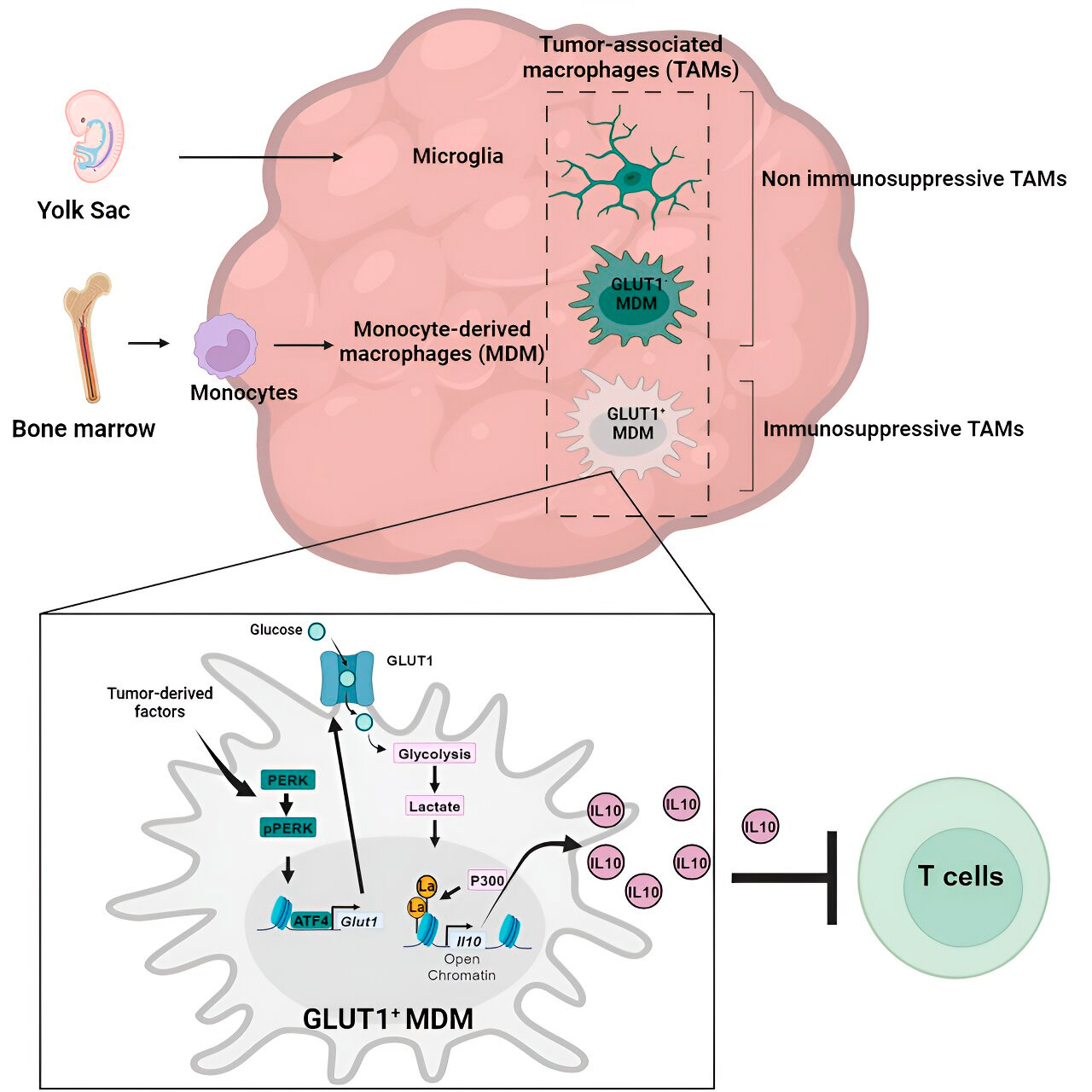
Gen- och metabolisk analys ledde dem till glukosmetabolism. En serie tester visade att monocyt-deriverade makrofager med ökad glukosmetabolism och uttryck av GLUT1, den huvudsakliga transportören för glukos, blockerade T-cellsfunktionen genom att frisätta interleukin-10 (IL-10).
Teamet visade att glioblastom stör glukosmetabolismen i dessa makrofager, vilket orsakar deras immunsuppressiva aktivitet.
Histonlaktylering och dess roll
Forskarna fann att nyckeln till den glukosmetabolismrelaterade immunsuppressiva aktiviteten hos monocyt-deriverade makrofager ligger i en process som kallas "histonlaktylering". Histoner är strukturella proteiner i genomet som spelar en nyckelroll i uttrycket av gener som IL-10 i vissa sammanhang.
Genom att snabbt metabolisera glukos producerar monocyt-deriverade makrofager laktat, en biprodukt av glukosmetabolismen. Histoner kan bli "laktylerade" (dvs. laktat integreras i histonerna) på ett sådant sätt att histonorganisationen främjar uttrycket av IL-10, vilket produceras av monocyt-deriverade makrofager för att stödja cancercellstillväxt.
Lösning på problemet
Men hur kan den immunsuppressiva aktiviteten hos monocyt-deriverade makrofager som är associerade med glukosmetabolism stoppas? Dr. Veglia och hans team identifierade en möjlig lösning: PERK, ett enzym som de identifierade som en regulator av glukosmetabolism och GLUT1-uttryck i makrofager.
I prekliniska modeller av glioblastom försämrade inriktning på PERK histonlaktylering och makrofagernas immunsuppressiva aktivitet. I kombination med immunterapi blockerades glioblastomprogression och inducerades långvarig immunitet som skyddade hjärnan från tumöråterväxt. Detta tyder på att inriktning på PERK-histonlaktyleringsaxeln kan vara en genomförbar strategi för att bekämpa denna dödliga hjärncancer.
