Nya publikationer
Mutation i ARID1A-genen gör tumörer känsliga för immunterapi
Senast recenserade: 02.07.2025

Allt iLive-innehåll är mediekontrollerat eller faktiskt kontrollerat för att säkerställa så mycket faktuell noggrannhet som möjligt.
Vi har strikta sourcing riktlinjer och endast länk till välrenommerade media webbplatser, akademiska forskningsinstitut och, när det är möjligt, medicinsk peer granskad studier. Observera att siffrorna inom parentes ([1], [2] etc.) är klickbara länkar till dessa studier.
Om du anser att något av vårt innehåll är felaktigt, omodernt eller på annat sätt tveksamt, välj det och tryck på Ctrl + Enter.
Immunterapi har revolutionerat cancerbehandlingen de senaste åren. Istället för att rikta in sig direkt på tumörer, riktar immunterapi patienternas immunsystem mot att attackera tumörer mer effektivt. Detta är särskilt effektivt för vissa svårbehandlade cancerformer. Emellertid svarar mindre än hälften av alla cancerpatienter på nuvarande immunterapier, vilket skapar ett akut behov av att identifiera biomarkörer som kan förutsäga vilka patienter som mest sannolikt kommer att dra nytta av behandlingen.
Nyligen har forskare noterat att patienter vars tumörer har en mutation i ARID1A-genen är mer benägna att svara positivt på immunkontrollblockad, en typ av immunterapi som fungerar genom att hålla cancerbekämpande immunceller aktiverade.
Eftersom ARID1A-genmutationen finns i många cancerformer, inklusive endometrie-, äggstocks-, kolorektal-, mag-, lever- och bukspottkörtelcancer, undrade forskare vid Salk Institute hur den kan bidra till behandlingskänslighet och hur kliniker kan använda denna information för att anpassa cancerbehandling för varje patient.
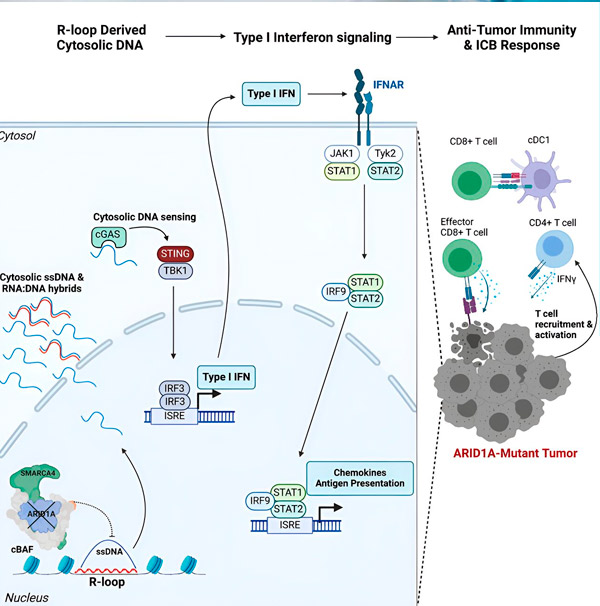
Deras nya studie, publicerad i tidskriften Cell, visar att ARID1A-mutationen gör tumörer känsliga för immunterapi genom att rekrytera cancerbekämpande immunceller till tumören genom ett antiviralliknande immunsvar.
Forskarna föreslår att denna mutation och det antivirala immunsvaret skulle kunna användas som en biomarkör för att bättre välja patienter för specifika immunterapier, såsom immunkontrollpunktsblockad. Dessa fynd uppmuntrar också utvecklingen av läkemedel som riktar sig mot ARID1A och relaterade proteiner för att göra andra tumörer mer känsliga för immunterapi.
”Detta skulle verkligen kunna förändra resultatet av cancerbehandling för patienter”, säger docent Diana Hargreaves, huvudförfattare till studien. ”Patienter med ARID1A-mutationen har redan ett immunsvar, så allt vi behöver göra är att förstärka det svaret med immunkontrollblockad för att hjälpa dem att förstöra sina tumörer inifrån.”
Även om det var känt att personer med ARID1A-mutationer svarade bra på immunkontrollblockad, förblev det exakta sambandet mellan de två oklart. För att belysa mekanismen använde forskare vid Salk Institute musmodeller av melanom och kolorektal cancer med både ARID1A-mutationen och funktionell ARID1A.
Källa: Cell (2024). DOI: 10.1016/j.cell.2024.04.025
Teamet observerade ett robust immunsvar i alla modeller med ARID1A-mutationen, men inte i de där ARID1A var funktionell, vilket stöder idén att ARID1A-mutationen faktiskt driver detta svar. Men hur fungerar detta på molekylär nivå?
"Vi fann att ARID1A spelar en viktig roll i cellkärnan genom att upprätthålla korrekt DNA-organisation", säger Matthew Maxwell, studiens förstaförfattare och doktorand vid Hargreaves-laboratoriet. "Utan funktionell ARID1A kan fritt DNA skäras ut och frigöras i cytosolen, vilket aktiverar ett önskvärt antiviralt immunsvar som kan förstärkas genom immunkontrollblockad."
ARID1A-genen kodar för ett protein som hjälper till att reglera formen på vårt DNA och upprätthålla genomets stabilitet. När ARID1A muterar sätter det igång en Rube-Goldberg-liknande händelsekedja i cancerceller.
För det första leder bristen på funktionellt ARID1A till att DNA frigörs i cytosolen. Det cytosoliska DNA:t aktiverar sedan ett antiviralt larmsystem, cGAS-STING-vägen, eftersom våra celler är anpassade för att markera allt DNA i cytosolen som främmande för att skydda mot virusinfektioner. I slutändan engagerar cGAS-STING-vägen immunförsvaret för att rekrytera T-celler till tumören och aktivera dem till specialiserade cancerdödande T-celler.
I varje steg, beroende på det föregående, leder denna händelsekedja – ARID1A-mutation, DNA-escape, cGAS-STING-larm, T-cellsrekrytering – till en ökning av antalet cancerbekämpande T-celler i tumören. Immunkontrollblockad kan sedan användas för att säkerställa att dessa T-celler förblir aktiverade, vilket förbättrar deras förmåga att besegra cancer.
"Våra fynd ger en ny molekylär mekanism genom vilken en ARID1A-mutation kan bidra till ett antitumörimmunsvar", säger Hargreaves. "Det som är spännande med dessa fynd är deras translationella potential. Vi kan använda ARID1A-mutationer för att välja patienter för immunkontrollblockad, och vi ser nu en mekanism genom vilken läkemedel som hämmar ARID1A eller dess proteinkomplex kan användas för att ytterligare förbättra immunterapi hos andra patienter."
Genom att beskriva mekanismen genom vilken immunkontrollpunktsblockad är mer effektiv vid ARID1A-muterade cancerformer, ger forskarna kliniker en motivering för att prioritera denna immunterapi för patienter med en ARID1A-mutation. Dessa fynd är ett viktigt steg mot att personifiera cancerbehandling och inspirerar utvecklingen av nya terapier som riktar sig mot ARID1A och dess proteinkomplex.
Framöver hoppas Salk Institute-teamet att deras resultat kommer att förbättra behandlingsresultaten för patienter med olika typer av cancer i samband med ARID1A-mutationer, och avser att utforska denna kliniska översättning i samarbete med University of California, San Diego.
