Nya publikationer
AI upptäcker prostatacancer i tidigt skede som patologer missar
Senast recenserade: 23.08.2025

Allt iLive-innehåll är mediekontrollerat eller faktiskt kontrollerat för att säkerställa så mycket faktuell noggrannhet som möjligt.
Vi har strikta sourcing riktlinjer och endast länk till välrenommerade media webbplatser, akademiska forskningsinstitut och, när det är möjligt, medicinsk peer granskad studier. Observera att siffrorna inom parentes ([1], [2] etc.) är klickbara länkar till dessa studier.
Om du anser att något av vårt innehåll är felaktigt, omodernt eller på annat sätt tveksamt, välj det och tryck på Ctrl + Enter.
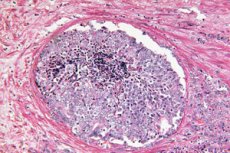
Vetenskapliga rapporter visar att artificiell intelligens kan känna igen dolda morfologiska ledtrådar till tumörer i prostatabiopsier som tidigare ansågs vara godartade av en patolog. En djupinlärningsmodell som tränats med hjälp av den svagt övervakade metoden förutspådde vilka män med förhöjt PSA som skulle utveckla kliniskt signifikant prostatacancer (ISUP > 1) under de kommande 30 månaderna och vilka som skulle förbli cancerfria i minst 8 år. Detta öppnar dörren för tidig riskstratifiering omedelbart efter en initial "ren" biopsi och kan hjälpa till att avgöra vem som verkligen behöver upprepade invasiva procedurer och förbättrad övervakning.
Bakgrund till studien
Primär nålbiopsi av prostata ger ofta falskt negativa resultat: en betydande andel av kliniskt signifikant cancer förblir "off-screen", särskilt med traditionell systematisk TRUS-biopsi. Införandet av MR-vägledning har ökat andelen kliniskt signifikant cancerupptäckt och minskat antalet onödiga upprepade procedurer, men även med moderna strategier förblir vissa aggressiva tumörer oupptäckta. Det kliniska dilemmat förblir detsamma: vem som ska observeras efter en "ren" biopsi och vem som ska remitteras för en tidig upprepad biopsi, för att inte försena diagnosen och inte överbelasta patienter med invasiva ingrepp.
Den biologiska grunden för att lösa detta problem är TINT-fenomenet (tumor-instructed/indicating normal tissue): en tumör "omkonfigurerar" de omgivande till synes normala vävnaderna i organet och lämnar svaga men systematiska spår i dem - från stromal ombyggnad och hypoxi till metaboliska förändringar. Dessa förändringar har beskrivits i experimentella modeller och hos patienter med prostatacancer och korrelerar med tumöraggressivitet, vilket gör "normal" vävnad till en potentiell källa till diagnostiska signaler, även om det inte finns några uppenbara cancerösa körtlar i biopsikärnan.
Digital patologi och djupinlärningsmetoder syftar till att extrahera sådana "subtila" fältfunktioner från vanliga H&E-snitt. Till skillnad från klassisk morfologi, som fokuserar på uppenbara tumörstrukturer, kan algoritmer fånga distribuerade mönster i stroma och epitel i samband med närvaron av en tumör i en annan del av organet. Detta öppnar vägen för risk för stratifiering omedelbart efter en negativ biopsi: en hög glas-"poäng" antyder lämpligheten av en tidig upprepad biopsi eller MR-vägledning, en låg stöder en mer skonsam observation.
Detta är idén bakom en ny studie i Scientific Reports: författarna testade huruvida AI kan förutsäga kliniskt signifikant prostatacancer under de kommande 30 månaderna baserat på morfologiska signaler från TINT-biopsier. Arbetet bygger vidare på en tidigare presenterad preprint och utgör en tillämpad grund för implementeringen av digitala biomarkörer i fält vid patientbesök efter en initial "ren" biopsi.
Hur det gjordes: design, data, algoritm
Författarna samlade retrospektivt in en kohort av 232 män med förhöjt PSA och en initial slutsats om "benign" vid nålbiopsi (efter teknisk kontroll inkluderades 213 patienter och 587 snitt i den slutliga analysen; biopsier 1997-2016, Umeå, Sverige). Varje patient matchades med ett "spegelpar" efter ålder, diagnosår och PSA-nivå: hälften diagnostiserades med prostatacancer senare (≤30 månader), den andra hälften förblev cancerfria i minst 8 år. H&E-bilder digitaliserades (20×), klipptes i 256×256 pixlar och matades till CLAM (Clustering-constrained Attention Multiple-Instance Learning) - ett modernt svagt övervakat schema, där endast patientens öde är känt, och inte markeringen av varje pixel. Funktioner extraherades av ResNet18 förtränat på 57 histopatologiska dataset. Endpoint är binär: låg risk (benign/ISUP1) vs. hög risk (ISUP2-5).
Förutsägelsenoggrannhet
I ett oberoende test uppnådde modellen en AUC på 0,81 över alla objektglas och en AUC på 0,82 på patientnivå. Vid ett tröskelvärde som gav en acceptabel balans var känsligheten 0,92 med en falskt positiv frekvens på 0,32 (patientnivå). Med andra ord, bland personer vars initiala biopsi "missade" flaggade AI:n korrekt den stora majoriteten av dem som snart bekräftades ha kliniskt signifikant cancer, om än till bekostnad av vissa falsklarm. För kliniken är detta en signal: "godartad" biopsirespons ≠ noll risk, och den kan stratifieras kvantitativt med digitalt glas.
Vad exakt "märker" AI i "normal" vävnad?
Tolkning via UMAP och uppmärksamhetskartor visade att stromala förändringar är de mest informativa:
- Mer kollagen i stromat (matrixkompaktering, ”fibros”);
- Färre glatta muskelceller runt körtlarna;
- Mindre vanligt är subtila signaler i körtelepitelet, troligen under den tillgängliga nedsamplingsupplösningen.
Detta mönster passar in i TINT-konceptet (tumour-instructed/indicating normal tissue): även "normen" i ett organ där en tumör är dold omkonfigureras under dess inflytande och skiljer sig från "normen" i ett organ utan tumör. Cancer är inte bara en nidus, utan också ett fält, och AI lär sig att läsa fälteffekten.
Hur metoden är användbar i praktiken – potentiella scenarier
- Riskbaserad rebiopsi: hög AI-frekvens på "rent" glas - argument för tidig rebiopsi eller MR-vägledning istället för att vänta.
- Personalisering av övervakning: Låg hastighet motverkar ångest efter "borderline" MRI och möjliggör måttlig övervakningsintensitet.
- TINT-mönsterträning: Uppmärksamhetskartor och interaktiva överlagringar hjälper patologer att se subtila fält runt cancer, vilket förbättrar rapporternas konsekvens.
Det är viktigt att förstå begränsningarna
Det är ett enda center i norra Sverige (övervägande kaukasisk population), designen är retrospektiv, baslinjebiopsierna utfördes utan MR-vägledning (systematiska TRUS-biopsier), och markörerna är framtida utfall snarare än "dold tumör på samma objektglas". Det finns ingen extern validering vid oberoende centra/skannrar ännu, och det finns inte heller en prospektiv studie av algoritmens effekt på kliniska beslut och utfall. Andelen falskt positiva resultat är fortfarande signifikant - modellen ersätter inte läkaren utan lägger till ett probabilistiskt lager för gemensamt beslutsfattande.
Vad händer nu: Implementeringsfärdplan
- Multicenter extern validering (olika skannrar, protokoll, etniska grupper).
- Prospektiva beslutsstudier: förändrar AI-poäng patientens utvecklingsbana (tid till diagnos, antal onödiga upprepade biopsier, över-/underdiagnos).
- Integration med MR och klinik: kombinerade modeller (PSA, MR PIRADS, kliniska faktorer + TINT-poäng enligt H&E).
- Tekniska steg: standardisering av digitalisering, kontroll av datadrift, förklarbarhet (uppmärksamhetöverlagringar för rutin).
Källa: Chelebian E., Avenel C., Järemo H., Andersson P., Bergh A., Wählby C., et al. Upptäckt av tumör som indikerar morfologiska förändringar i godartade prostatabiopsier genom AI. Scientific Reports (Nature Portfolio), publicerad 21 augusti 2025. DOI: https://doi.org/10.1038/s41598-025-15105-6
