Nya publikationer
Derivat av talidomidföreningar leder till att resistenta cancerceller dör
Senast recenserade: 02.07.2025

Allt iLive-innehåll är mediekontrollerat eller faktiskt kontrollerat för att säkerställa så mycket faktuell noggrannhet som möjligt.
Vi har strikta sourcing riktlinjer och endast länk till välrenommerade media webbplatser, akademiska forskningsinstitut och, när det är möjligt, medicinsk peer granskad studier. Observera att siffrorna inom parentes ([1], [2] etc.) är klickbara länkar till dessa studier.
Om du anser att något av vårt innehåll är felaktigt, omodernt eller på annat sätt tveksamt, välj det och tryck på Ctrl + Enter.
En studie utförd av Goethe-universitetet i Frankfurt pekar på möjligheten att talidomidderivat potentiellt skulle kunna användas för att behandla cancer. Talidomid såldes som ett sömnmedel på 1950-talet. Det blev senare ökänt för att orsaka allvarliga fosterskador i tidiga skeden av graviditeten.
Molekylen är också känd för att markera proteiner i cellen för destruktion. Som en del av den aktuella studien skapade forskare derivat av talidomid. De kunde visa att dessa ämnen påverkar destruktionen av proteiner som är ansvariga för cancercellers överlevnad.
Kanske har ingen annan molekyl haft ett så turbulent förflutet som talidomid. Det var huvudingrediensen i ett läkemedel som godkändes i många länder på 1950-talet som ett lugnande medel och sömnmedel. Men det blev snart tydligt att gravida kvinnor som tog talidomid ofta födde barn med allvarliga missbildningar.
Under de senaste decennierna har medicinen dock återigen satt stora förhoppningar till det. Studier har bland annat visat att det hämmar tillväxten av blodkärl och därför potentiellt är lämpligt för att skära av tumörer från sitt näringsmedium. Sedan visade det sig också vara mycket effektivt vid behandling av multipelt myelom, maligna tumörer i benmärgen.
"Vi vet nu att talidomid kan kallas ett 'molekylärt lim'", förklarar Dr Xinglai Cheng vid Institutet för farmaceutisk kemi vid Goethe-universitetet i Frankfurt. "Det betyder att det kan gripa tag i två proteiner och sammanfoga dem."
Detta är särskilt intressant eftersom ett av dessa proteiner är en sorts "märkningsmaskin": den fäster en entydig "SKRÄP"-märkning på ett annat protein.
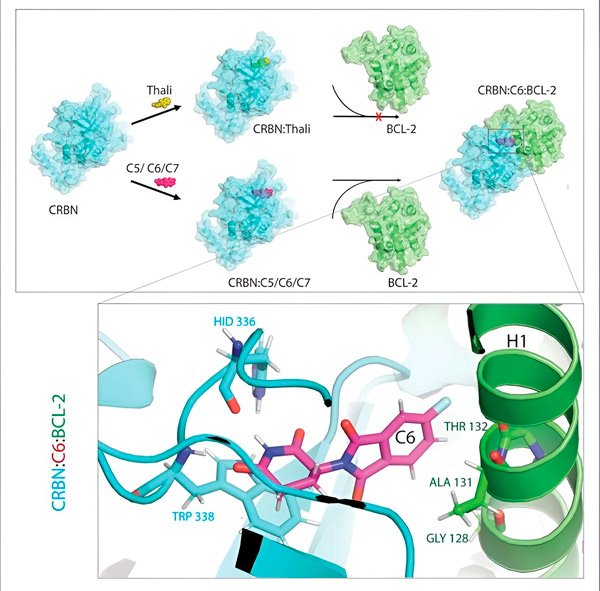
Thalidomidderivaten C5, C6 och C7 förändrar CRBN, "märkningsmaskinen", så att den kan binda till BCL-2. På detta sätt markeras BCL-2-molekylen för nedbrytning – en möjlig ny strategi för att bekämpa cancer. Författare: Dr. Xinglai Cheng.
Cellens avfallssystem känner igen denna tagg: Den griper tag i den taggade proteinmolekylen och strimlar den. "Denna mekanism förklarar de olika effekterna av talidomid", säger Cheng. "Beroende på vilket protein som är taggat kan det orsaka missbildningar under embryonal utveckling eller förstöra maligna celler."
Denna mekanism öppnar upp stora möjligheter för medicin, eftersom cancerceller är beroende av vissa proteiner för att överleva. Om de systematiskt kunde målsökas och strimlas, kanske sjukdomen skulle kunna botas. Problemet är att det molekylära limmet är ganska säreget.
En av dess bindningspartners är alltid cellens märkningsmaskin, eller, i vetenskapligt språkbruk, en E3-ligas som kallas CRBN. Endast ett fåtal av de många tusentals proteinerna i kroppen kan vara den andra partnern – vilka beror på limmet.
"Så vi skapade en serie talidomidderivat", säger Cheng. "Vi testade sedan om de hade vidhäftande egenskaper och, i så fall, vilka proteiner de var effektiva mot." För att göra detta tillsatte forskarna sina derivat till alla proteiner i den odlade cellinjen. De observerade sedan vilka av dessa proteiner som sedan bröts ner i närvaro av CRBN.
"Under processen identifierade vi tre derivat som skulle kunna märka ett cellulärt protein som är mycket viktigt för nedbrytning, BCL-2", förklarar Cheng. "BCL-2 hindrar cellerna från att aktivera sitt självförstörelseprogram, så om det inte finns där dör cellerna."
Det är därför BCL-2 länge har varit i fokus för cancerforskning. Det finns till och med ett leukemiläkemedel som heter venetoklax som minskar effektiviteten hos BCL-2 och därmed får muterade celler att självförstöras.
"I många cancerceller är dock BCL-2 i sig muterat. Som ett resultat hämmar venetoklax inte längre proteinet", säger Cheng. "Vi kunde visa att våra derivat också flaggar denna muterade form för nedbrytning. Dessutom simulerade våra partners vid Max Planck-institutet för biofysik interaktionen mellan talidomidderivat och BCL-2 på en dator. Detta visade att derivaten binder till helt andra platser än venetoklax – ett resultat som vi senare kunde bekräfta experimentellt."
Forskarna testade även sina föreningar på fruktflugor med cancerceller. Överlevnadsgraden för flugorna som behandlades på detta sätt var betydligt högre. Cheng varnar dock för att ha för höga förhoppningar, eftersom dessa resultat fortfarande är grundforskning. "Även om de visar att de modifierade talidomidmolekylerna har stor terapeutisk potential, kan vi ännu inte säga om de kommer att bevisa sig i praktiken någon gång."
Resultaten av studien publicerades i tidskriften Cell Reports Physical Science.
