Nya publikationer
Protein som orsakar genetisk inflammatorisk sjukdom identifierat
Senast recenserade: 02.07.2025

Allt iLive-innehåll är mediekontrollerat eller faktiskt kontrollerat för att säkerställa så mycket faktuell noggrannhet som möjligt.
Vi har strikta sourcing riktlinjer och endast länk till välrenommerade media webbplatser, akademiska forskningsinstitut och, när det är möjligt, medicinsk peer granskad studier. Observera att siffrorna inom parentes ([1], [2] etc.) är klickbara länkar till dessa studier.
Om du anser att något av vårt innehåll är felaktigt, omodernt eller på annat sätt tveksamt, välj det och tryck på Ctrl + Enter.
Ett forskarteam lett av Dr. Hirotsugu Oda från CECAD Cluster of Excellence for Aging Research vid Kölns universitet har upptäckt vilken roll ett visst proteinkomplex spelar i vissa former av immunförsvarsdysreglering. Detta resultat kan leda till utvecklingen av nya terapeutiska metoder som syftar till att minska autoinflation och "återställa" immunförsvaret hos patienter som lider av en genetisk dysfunktion i detta proteinkomplex.
Studien, "Bialelisk human SHARPIN-förlust av funktion inducerar autoinflammation och immunbrist", publicerades i tidskriften Nature Immunology.
Det linjära ubiquitin-assemblerande komplexet (LUBAC), som består av proteinerna HOIP, HOIL-1 och SHARPIN, har länge varit känt för sin avgörande roll i att upprätthålla immunhomeostas. Tidigare studier på möss har visat de allvarliga konsekvenserna av SHARPIN-förlust, vilket leder till allvarlig dermatit på grund av överdriven celldöd i huden. De specifika hälsokonsekvenserna av SHARPIN-brist hos människor har dock förblivit oklara.
Forskargruppen rapporterade för första gången två personer med SHARPIN-brist som uppvisar symtom på autoinflation och immunbrist, men oväntat nog inte uppvisar dermatologiska problem som de gjorde hos möss.
Vid vidare undersökning fann man att dessa individer hade ett försämrat kanoniskt NF-κB-svar, en viktig immunsvarsväg. De hade också ökad känslighet för celldöd inducerad av medlemmar i tumörnekrosfaktor (TNF)-superfamiljen. Behandling av en SHARPIN-bristfällig patient med anti-TNF-behandling, som specifikt hämmar TNF-inducerad celldöd, resulterade i fullständig upplösning av autoinflationen på cellnivå och i klinisk presentation.
Studien visar att överdriven och okontrollerad celldöd spelar en avgörande roll i genetiska inflammatoriska sjukdomar hos människor. Odas team lade till SHARPIN-brist som en ny medlem i en grupp genetiska inflammatoriska sjukdomar hos människor som de föreslår att kalla "medfödda celldödsfel".
Skydd mot immunförsvarsstörningar Studien inleddes i Dr. Dan Kastners laboratorium vid National Institutes of Health (NIH) i USA. Forskarna där fick möjlighet att observera en patient med oförklarliga episoder av feber, artrit, kolit och immunbrist som debuterade i barndomen.
Efter att ha inhämtat informerat samtycke utförde de exomsekvensering på patienten och dennes familjemedlemmar och fann att patienten hade en förödande genetisk variant i SHARPIN-genen som ledde till oupptäckbara nivåer av SHARPIN-proteinet. De fann också att patientens celler uppvisade en ökad benägenhet att dö i både odlade celler och i patientens biopsier.
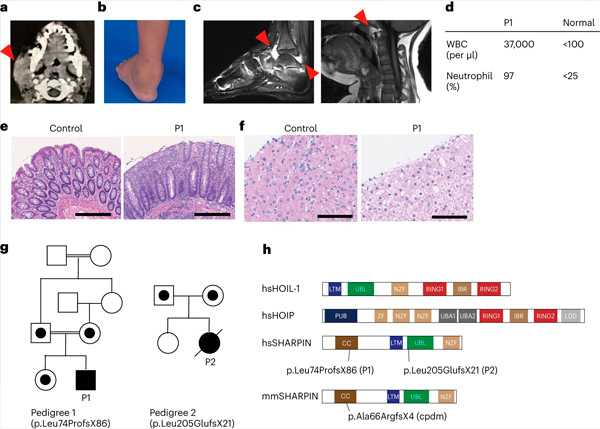
SHARPIN-brist hos människor orsakar autoinflammation och leverglykogenos. Källa: Nature Immunology (2024). DOI: 10.1038/s41590-024-01817-w
Teamet fann också att utvecklingen av lymfoida germinala centra – specialiserade mikrostrukturer i polyparna som är avgörande för mognaden av vårt immunsystems B-celler och därmed för antikroppsproduktion – minskade signifikant på grund av ökad B-cellsdöd. Dessa fynd förklarar patienternas immunbrist och belyser LUBAC:s viktiga roll för att upprätthålla immunhomeostas hos människor.
"Vår studie belyser den avgörande betydelsen av LUBAC för att skydda mot immunförsvarsdysreglering. Genom att belysa de molekylära mekanismerna bakom LUBAC-brist banar vi väg för nya terapeutiska strategier som syftar till att återställa immunförsvarets homeostas", säger Oda, huvudförfattare till studien.
Han tillade: ”En av patienterna med SHARPIN-brist hade varit rullstolsbunden i flera år innan vi träffade honom första gången. Hans vrister var inflammerade och det var för smärtsamt att gå. Den genetiska diagnosen gjorde det möjligt för oss att hitta rätt molekylära signalväg som ligger bakom hans tillstånd.”
Sedan patienten började få TNF-hämmare har han varit symptomfri i nästan sju år. ”Som kliniker och forskare är jag glad över att ha möjligheten att positivt påverka en patients liv genom vår forskning”, avslutade Oda.
